题目内容
【题目】珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
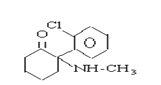
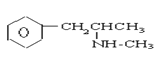
氯胺酮(K粉) 冰毒
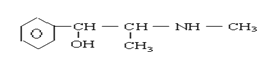
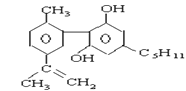
摇头丸 大麻
A.K粉的分子式为C13H16ClNO
B.这四种毒品都属于芳香烃
C.1mol大麻最多可与含4mol Br2的浓溴水发生反应
D.摇头丸不可能发生加成反应
【答案】A
【解析】
A.K粉的结构简式为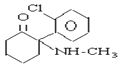 ,K粉的分子式为C13H16ClNO,故A正确;
,K粉的分子式为C13H16ClNO,故A正确;
B.芳香烃是指含有苯环的烃,这四种毒品都属于烃的衍生物,不属于芳香烃,故B错误;
C.大麻中的碳碳双键可与Br2发生加成反应,酚羟基邻、对位的苯环氢可与浓溴水发生取代反应,所以1mol大麻最多可与含3molBr2的浓溴水发生反应,故C错误;
D.摇头丸中含苯环,摇头丸中的苯环能在一定条件下与H2等发生加成反应,故D错误;
故选A。

【题目】某实验小组同学对影响 CuSO4 溶液和浓氨水反应产物的因素进行了如下探究。
(查阅资料)
①Cu(OH)2(s) Cu2+ + 2OH- Ksp = 2.2×10-20;![]() Cu2+ + 4NH3 K = 4.8×10-14
Cu2+ + 4NH3 K = 4.8×10-14
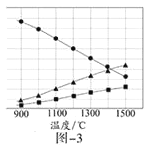
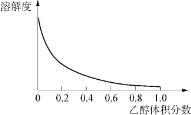
②Cu(NH3)4SO4·H2O 是一种易溶于水、难溶于乙醇的深蓝色固体, 加热分解有氨气放出。Cu(NH3)4SO4·H2O 在乙醇-水混合溶剂中的溶解度如下图所示。
(实验 1)CuSO4 溶液和浓氨水的反应。
序号 | 实验内容 | 实验现象 |
1-1 | 向 2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入 2 mL 1 mol/L 氨水 | 立即出现浅蓝色沉淀,溶液变无色; 随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液 A |
1-2 | 向 2 mL 1 mol/L 氨水中逐滴加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液 B |
(1)进一步实验证明,深蓝色溶液 A、B 中均含有![]() ,相应的实验方案为______________________(写出实验操作及现象)。
,相应的实验方案为______________________(写出实验操作及现象)。
(实验 2)探究影响 CuSO4 溶液和浓氨水反应产物的因素。
序号 | 实验内容 | 实验现象 |
2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4 溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
序号 | 实验内容 | 实验现象 |
2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________。
②试剂 a 为 ___________________________。
(3)利用平衡移动原理对实验 2-2 的现象进行解释:____________________________。
(4)实验 2-3 的目的是__________________________。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有________________________。
【题目】芳香酸是分子中羧基与苯环直接相连的一类有机物,通常用芳香烃的氧化来制备。反应原理如下:
![]() +2KMnO4
+2KMnO4![]() +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
![]() +HCl
+HCl![]() +KCl
+KCl
反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水中的溶解性 |
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 |
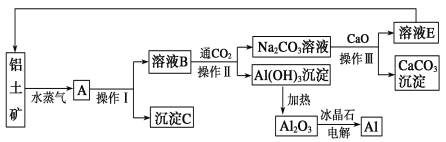
主要实验装置和流程如图:
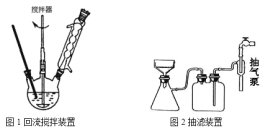
实验方法:一定量的甲苯和KMnO4溶液加入图1装置中,在90℃时,反应一段时间后,停止反应,按如图流程分离出苯甲酸并回收未反应的甲苯。
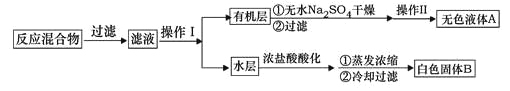
(1)白色固体B中主要成分的分子式为______,操作Ⅱ为______。
(2)下列关于仪器的组装或者使用正确的是______。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.如图回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是上进下出
(3)除去残留在苯甲酸中的甲苯应先加入______,分液,然后再向水层中加入______,抽滤,洗涤,干燥即可得到苯甲酸。
(4)纯度测定:称取2.440g产品,配成100mL溶液,取其中25.00mL溶液,行滴定,消耗KOH物质的量为4.5×10-3mol。产品中苯甲酸质量分数为______。
【题目】已知氯气和氢氧化钠的反应条件不同,产物也不同,在实验室里可用如图所示装置制取氯酸钠次氯酸钠和探究氯水的性质。
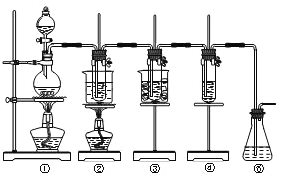
图中:①为氯气发生装置;②的试管里盛有15mL 30% NaOH溶液,并置于热水浴中;
③的试管里盛有15mL 8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_________(填写下列编号字母)的净化装置。
A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(2)比较制取氯酸钠和次氯酸钠的条件,指出二者的差异:______________________。
(3)本实验中制取次氯酸钠的离子方程式是__________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
实验现象 | 原因 |
溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 | _________________ |
然后溶液从无色逐渐变为_______色 | __________________________________ |