题目内容
4.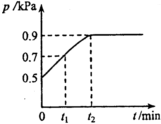 在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )
在1.0L密闭容器中放入0.10mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0,容器内气体总压强p随反应时间t的变化关系如图所示.以下分析不正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.04}{{t}_{1}}$mol(L•min) | |
| B. | 该温度下此反应的平衡常数K=$\frac{0.32}{{t}_{2}}$ | |
| C. | 欲提高平衡体系中Y的含量,可降低体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.10 mol气体X,平衡正向移动,X的转化率增大 |
分析 A.利用三段式法计算P为0.7KPa时参加反应的X的物质的量,再根据v=$\frac{△c}{△t}$进行计算;
B.利用三段式法计算平衡状态时即P为0.9KPa时各物质的浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
C.降温,平衡正向移动;减少Z的量,平衡正向移动;
D.正反应为气体体积增大的反应,X转化率降低.
解答 解:A.设P为0.7KPa时参加反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始(mol) 0.10 0 0
转化(mol) x x x
0.7KPa(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,则$\frac{0.10-x+x+x}{0.10}=\frac{0.7}{0.5}$,解得x=0.04,
则v(X)=$\frac{\frac{0.04mol}{1.0L}}{{t}_{1}}$mol/(L•min)=$\frac{0.04}{{t}_{1}}$mol/(L•min),故A正确;
B.设平衡状态时参加反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
平衡量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,则$\frac{0.10-x+x+x}{0.10}=\frac{0.9}{0.5}$,解得x=0.08,
容器体积为1.0L,所以K=$\frac{c(Y)•c(Z)}{c(X)}$=$\frac{0.08×0.08}{0.10-0.08}$=0.32,故B错误;
C.该反应正反应为放热反应,降温,平衡正向移动,平衡体系中Y的含量增大;减少Z的量,平衡正向移动,平衡体系中Y的含量增大,故C正确;
D.恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低,故D错误;
故选BD.
点评 本题考查了三段式法在平衡计算中的应用、化学平衡移动原理及平衡常数的计算,题目难度中等.

| A. | 火力发电厂的燃煤中加适量石灰石,有利于环境保护 | |
| B. | 硅胶可做装食品的干燥剂 | |
| C. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 | |
| D. | 利用农作物秸秆制取乙醇 |
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| A. | 标准状况下,2.24L苯含有的分子数为0.1nA | |
| B. | 25℃时,PH=13的Ba(OH)2的溶液中含有OH-的数目为0.2nA | |
| C. | 1L0.1mol•L-1Al2(SO4 )3的溶液Al3+的数目为0.2nA | |
| D. | 1.5molNO2与足量H2O反应,转移的电子数为nA |
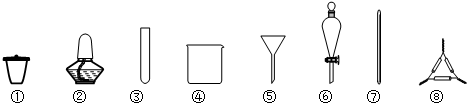
| A. | 海带灼烧灰化,选用①②⑧ | B. | 加水浸泡加热,选用②④⑦ | ||
| C. | 过滤得到滤液,选用④⑤⑦ | D. | 萃取和分液,选用③④⑥ |
| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | 相同浓度和体积的强酸与强碱溶液混合后,溶液的PH=7 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 若反应2A(g)+B(g)=2C(g)在一定条件下是一个自发的反应,则该反应为吸热反应 |
| A. | 氢氧化铝和硝酸溶液反应 | B. | Fe(OH)3溶液和硫酸反应 | ||
| C. | 氢氧化钡溶液和稀硫酸 | D. | KOH溶液和稀硝酸反应 |
| A. | A沸点比B高 | |
| B. | A相对密度比B小 | |
| C. | 一般情况下,同碳原子的烷烃的沸点和密度低于烯烃 | |
| D. | 已知A在常温下为液态,则B不可能为气态 |
