题目内容
11. 氨气是一种重要的化工原料,在工农业中都有广泛的应用.
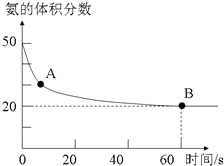
氨气是一种重要的化工原料,在工农业中都有广泛的应用.(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素.在恒定温度下,混合气体中NH3的含量随时间的变化关系如图所示(该条件下尿素为固体).A点的正反应速率v正(CO2)大于B点的逆反应速率v逆(CO2)(填“大于”、“小于”或“等于”),NH3的平衡转化率为75%.
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程中的中间产物.现将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)?NH2COONH4(s).实验测得在不同温度下的平衡数据如下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
②若从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,反应物的转化率将不变(填“增大”、“减小”或“不变”).
(3)向含a mol NH4NO3的溶液中滴加b L氨水后溶液恰好呈中性,则滴加氨水的过程中水的电离平衡将
逆向(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1(25℃时,NH3•H2O的电离平衡常数Kb=2×10-5)
分析 (1)图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率;
(2)①根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应;
反应物是气体,产物是固体,该反应是熵减小的过程;
根据平衡三段式计算各物质的平衡浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行列式;
③固体量的变化,对平衡不产生影响;
(3)一水合氨对铵根离子水解起到抑制作用;
依据一水合氨的电离平衡常数计算得到氨水浓度.
解答 解:(1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3?(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨气的体积分数=$\frac{50-x}{50-0.5x+50-x+0.5x}×100%$=20%;解得x=37.5mol,
氨气的平衡转化率=$\frac{37.5mol}{50mol}$×100%=75%,
故答案为:大于;75%;
(2)①根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应,故△H<0;
反应物是气体,产物是固体,该反应是熵减小的过程,即,△S<0,反应NH2COONH4(s)?2NH3(g)+CO2(g),设二氧化碳浓度的变化量x,
2NH3(g)+CO2(g)?NH2COONH4(s).
初始浓度 0 0
变化浓度:2x x
平衡浓度:2x x
则3x=2.4×10-3mol/L,即x=0.8×10-3mol/L,2x=1.6×10-3mol/L,
K=$\frac{1}{{c}^{2}(N{H}_{3})•c(C{O}_{2})}$=$\frac{1}{(1.6×1{0}^{-3})^{2}×(0.8×1{0}^{-3})}$,
故答案为:<;<;$\frac{1}{(1.6×1{0}^{-3})^{2}×(0.8×1{0}^{-3})}$;
③从已达平衡状态的上述容器中分离出少量的氨基甲酸铵晶体,对平衡不产生影响,故反应物的转化率将不变,
故答案为:不变;
(3)加入氨水溶液抑制铵根离子水解,平衡逆向进行;
将amolNH4NO3溶于水,向该溶液滴加bL 氨水后溶液呈中性,依据电荷守恒可知,溶液中氢氧根离子浓度=10-7mol/L,c(NH4+)=c(NO3-);NH3•H2O的电离平衡常数取Kb=2×10-5mol•L-1,设混合后溶液体积为1L,则(NH4+)=c(NO3-)=amol/L;根据一水合氨电离平衡得到:NH3•H2O?NH4++OH-,
平衡常数K=$\frac{c(N{H}_{{4}^{+}})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{amol/L×1{0}^{-7}mol/L}{[b×c(N{H}_{3}.{H}_{2}O]mol/L}$=2×10-5mol•L-1,解得c(NH3•H2O)=$\frac{a}{200b}$mol/L,
故答案为:逆向;$\frac{a}{200b}$.
点评 本题考查化学反应速率、化学平衡的移动原理、平衡常数的计算、弱电解质溶液中的电离平衡的计算应用等知识,综合性较大,难度中等.

| A. | 氨水加水稀释后,溶液中c (NH3•H2O)/c (NH4+)的值减小,c (H+)增大 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| C. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次增强 | |
| D. | 加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝 |
| 实验操作设计 | 现象记录 | 结论解释 | |
| A | 将少量浓硝酸逐滴加入Cu 和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯 上加热 | 铝箔熔化但并不滴落 | 熔点:Al2 O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化 亚铁溶液已经变质 |
| D | 向紫色石蕊试液中持续长时 间通人氯气 | 溶液先变红,最后变 为无色 | 氯气有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| B. | 相同浓度和体积的强酸与强碱溶液混合后,溶液的PH=7 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 若反应2A(g)+B(g)=2C(g)在一定条件下是一个自发的反应,则该反应为吸热反应 |

 请你利用所学反应原理知识解决下列问题:
请你利用所学反应原理知识解决下列问题: