题目内容
1.已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-Q1 kJ•mol-12H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ•mol-12H2(g)+O2(g)═2H2O(l)△H=-Q3 kJ•mol-1常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况)经完全燃烧后恢复到常温,则放出的热量为( )| A. | (0.4 Q1+0.05 Q3) kJ | B. | (0.4 Q1+0.05 Q2) kJ | ||
| C. | (0.4 Q1+0.1 Q3) kJ | D. | (0.4Q1+0.2 Q1) kJ |
分析 根据混合气体的体积计算混合气体的物质的量,结合气体体积比计算甲烷、氢气的物质的量,再根据热化学反应方程式计算放出的热量.注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算.
解答 解:甲烷和氢气的混合气体11.2L(已折合成标准状况),所以甲烷和氢气的混合气体的总的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×$\frac{4}{5}$=0.4mol,氢气的物质的量为0.5mol-0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-Q1kJ/mol可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由2H2(g)+O2(g)═2H2O(l)△H=-Q3kJ/mol可知,
0.1mol氢气燃烧生成液态水放出的热量为0.1mol×$\frac{1}{2}$×Q3kJ/mol=0.05Q3kJ.
所以放出的热量为0.4Q1+0.05Q3.
故选A.
点评 本题考查根据热化学方程式计算反应热,难度不大,注意根据水的状态选择相应的热化学方程式计算反应热.

练习册系列答案
相关题目
20.下列解释事实的方程式表达不正确的是( )
| A. | 氨水呈碱性:NH3•H2O=NH4++OH- | |
| B. | 碳酸氢钠治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | 久置的浓硝酸呈黄色:4HNO3=4NO2↑+O2↑+2H2O | |
| D. | 久置碳酸氢铵有刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O |
6.0.1L某溶液含有0.1mol KCl和0.1mol CaCl2,此溶液中Cl-的物质的量浓度是( )
| A. | 3mol•L-1 | B. | 0.2mol•L-1 | C. | 0.3mol•L-1 | D. | 0.1mol•L-1 |
13.设NA为阿伏加德罗常数,则下列叙述中正确的是( )
| A. | 6.02×1022个H2SO4分子在水中可电离生成2NA个H+ | |
| B. | 在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 14 g氮气中含有7NA个电子 | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
 ;若XY2为共价化合物时,其电子式为:
;若XY2为共价化合物时,其电子式为: .
.
 ;
; ;
; .
.
 ;
;
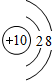 .
.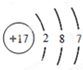 .
.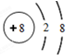
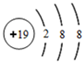 .
.