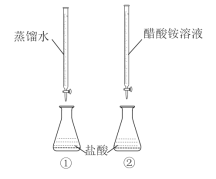
题目内容
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
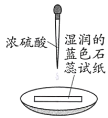
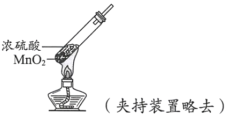
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性
【答案】A
【解析】
A.试纸中心区域变黑,说明试纸中的H元素和O元素被脱去,只剩下C,证明浓硫酸具有脱水性,A正确;
B.蓝色石蕊试纸边缘变红,证明浓硫酸具有酸性,不能证明浓硫酸有弱酸性,B错误;
C.浓硫酸与MnO2反应后,Mn元素仅以![]() 存在,说明Mn元素化合价降低,表现氧化性,产生能使带火星的木条复燃的无色气体,说明生成O2。但由于Mn元素也表现氧化性,且实验中没有说明有硫酸的还原产物生成,故不能体现浓硫酸的强氧化性,C错误;
存在,说明Mn元素化合价降低,表现氧化性,产生能使带火星的木条复燃的无色气体,说明生成O2。但由于Mn元素也表现氧化性,且实验中没有说明有硫酸的还原产物生成,故不能体现浓硫酸的强氧化性,C错误;
D.浓硫酸与MnO2反应没有体现出浓硫酸的吸水性,D错误;
故选A。

 名校课堂系列答案
名校课堂系列答案【题目】(1)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
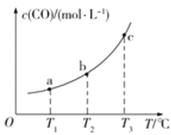
①该反应△H_____________0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_____________K2(填“>”、“<”或“=”)。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
2MoO3(s)+4SO2(g)ΔH。测得氧气的平衡转化率与起始压强、温度的关系如图所示:
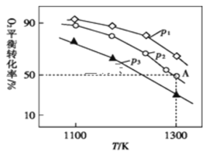
①p1、p2、p3的大小:___________。
②若初始时通入7.0molO2,p2为7.0kPa,则A点平衡常数Kp=___________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
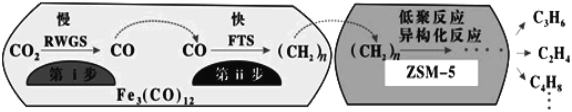
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是:___________
②下列说法正确的是______;
a.第ⅰ步的反应为:CO2+H2![]() CO+H2O
CO+H2O
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同