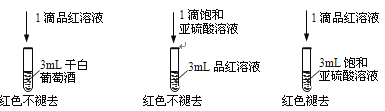
题目内容
【题目】常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。
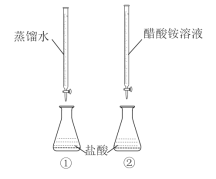
下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
【答案】C
【解析】
A.向盐酸中滴加水,盐酸被稀释浓度降低,溶液中c(H+)减小,由于溶液中存在水的电离平衡,水的离子积不变,所以溶液中c(OH-)会增大,A错误;
B.当溶液pH=2时,c(H+)=0.01 mol/L,根据电荷守恒可知:c(Cl-)+c(CH3COO-)+c(OH-)=c(H+)+c(NH4+),所以c(Cl-)+c(CH3COO-)+c(OH-)- c(NH4+)=c(H+)=0.01 mol/L,则c(Cl-)+c(CH3COO-)+c(OH-)>0.01 mol/L,B错误;
C.由于酸性:HCl>CH3COOH,CH3COOH是弱酸,所以将CH3COONH4溶液滴加到盐酸中,会发生反应:HCl+CH3COONH4=CH3COOH+NH4Cl,而NH4+不发生反应,仅有少量发生水解而消耗,且在酸溶液中水解程度会减弱,因此实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+),C正确;
D.滴定结束后,①为稀HCl,②中发生的反应HCl+CH3COONH4=CH3COOH+NH4Cl恰好完全,最终得到等浓度的CH3COOH和NH4Cl混合溶液,①中HCl的浓度与②中CH3COOH浓度相等,由于酸电离产生H+会抑制水的电离,但醋酸是弱酸,其电离对水的电离的抑制作用远小于等浓度的盐酸,且②溶液中还存在NH4Cl会促进水的电离平衡,故滴定结束后,①中水的电离程度比②中小,D错误;
故合理选项是C。

 阅读快车系列答案
阅读快车系列答案【题目】科学家一直致力于“人工固氮”的新方法研究。
Ⅰ.目前合成氨技术原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1。
2NH3(g) △H=-92.4kJ·mol-1。
(1)在一定体积的容器中发生上述反应,下列描述中能说明该反应已达平衡的是______
A.容器内气体的平均摩尔质量保持不变
B.2v(NH3)正=v(N2)逆
C.容器中气体的压强保持不变
D.N2、H2、NH3的物质的量之比为1:2:3
(2)673K、30MPa下,向容积为2.0L的恒容密闭容器中充入0.80mol N2和1.60mol H2,反应3分钟达到平衡时,NH3的体积分数为20%。
①该条件下反应:N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
2NH3(g)的平衡常数K=_____(精确到小数点后一位);K值越大,表明反应达到平衡时______
A.H2的转化率一定越高 B.NH3的浓度一定越大
C.正反应进行得越完全 D.化学反应速率越大
②若达平衡后再向该容器中充入0.40mol N2和0.40mol NH3,该平衡将______(填“向正反应方向移动”、“向逆反应方向移动”或“不移动”)。
Ⅱ.根据“人工固氮”的最新研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
4NH3(g)+3O2(g) △H=a kJ·mol-1。进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
(1)此合成反应的a_____0;ΔS______0,(填“>”、“<”或“=”)。
(2)已知(K为平衡常数):N2(g)+3H2(g)![]() 2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
2NH3(g) K1,2H2(g)+O2(g)=2H2O(l) K2,则N2(g)+3H2O(1)=2NH3(g)+O2(g)的K=______(用K1、K2表示)。
Ⅲ.已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(1) ΔH= -1316kJ·mol-1,氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料,该燃料电池的负极反应式是_______。
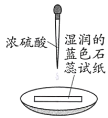
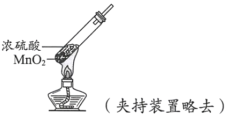
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性