题目内容
9.二氧化氯是一种在水处理等方面有广泛应用的高效安全消毒剂.请回答下列有关问题.(1)ClO2的制备方法比较实用的有数十种,下列是几种常见的方法.
方法一:2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O对于该反应,下列说法中正确的是AD.
A.该反应中Cl2是氧化产物
B.该反应中NaCl、ClO2是还原产物
C.在反应中HCl既作氧化剂又具有酸的作用
D.1mol NaClO3参加反应时,有1mol电子发生转移
E.1mol NaClO3参加反应,理论上能得到33.6L气体
方法二:氯化钠电解法
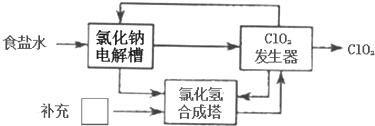
该法工艺原理如图.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2.指出工艺中方框中物质为Cl2(填化学式),理由为在ClO2发生器中反应生成的Cl2少于合成HCl所需的量.
(2)将NCl3与NaClO2(亚氯酸钠)按物质的量之比1:6混合,在碱性溶液中恰好反应生成ClO2,试写出该反应的离子方程式NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑.
(3)在用ClO2进行水处理时,除了杀菌消毒外,还能除去水中的Fe2+和Mn2+.试写出用ClO2氧化除去Mn2+生成MnO2的离子方程式2ClO2+Mn2++2H2O=MnO2↓+2ClO3-+4H+(ClO2反应后的产物为ClO${\;}_{2}^{-}$.
分析 (1)反应2NaClO3+4HCl(浓)═2NaCl+Cl2↑+2ClO2↑+2H2O中,只有Cl元素化合价发生变化,NaClO3为氧化剂,HCl为还原剂,并起到酸的作用;
电解槽中发生NaCl+3H2O$\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑,NaClO3和盐酸发生歧化反应,生成NaCl、2ClO2、Cl2、H2O,化学方程式为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,合成HCl,发生器中生成的氯气不足,应补充氯气;
(2)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气;
(3)ClO2氧化除去Mn2+,生成二氧化锰、氯酸根离子和氢离子;
解答 解:(1)A.Cl元素化合价升高,被氧化,则该反应中Cl2是氧化产物,故A正确;
B.该反应中NaCl不是还原产物,故B错误;
C.在反应中HCl既作还原剂有具有酸的作用,故C错误
D.Cl元素化合价由+5价降低到+4价,则1mol NaClO3参加反应时,有1mol电子发生转移,故D正确;
E.气体存在的条件未知,不能确定体积,
电解槽中发生NaCl+3H2O$\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑,NaClO3和盐酸发生歧化反应,生成NaCl、2ClO2、Cl2、H2O,化学方程式为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,合成HCl,发生器中生成的氯气不足,应补充氯气;
故答案为:AD;Cl2;在ClO2发生器中反应生成的Cl2少于合成HCl所需的量;
(2)NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,则该反应的离子反应为NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑,故答案为:NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑;
(3)ClO2氧化除去Mn2+的离子方程式为:2ClO2+Mn2++2H2O=MnO2↓+2ClO3-+4H+,故答案为:2ClO2+Mn2++2H2O=MnO2↓+2ClO3-+4H+
点评 本题考查较为综合,涉及氧化还原反应以及物质的制备方案的设计、电解原理等知识,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目难度中等.

| A. | 都是2mol/L | B. | 都是3mol/L | ||
| C. | 1.5mol/L和3mol/L | D. | 分别是1mol/L和4mol/L |
| A. | 3:4 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
| A. | 常温下将铜丝插入浓硫酸中,会产生有刺激性气味的气体,且溶液的变为蓝色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,无法得到无水CuCl2固体 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,既除去铜绿,又不能损伤铜器 |
| A. | 无色溶液中:Al3+、Cu2+、Cl-、SO42- | |
| B. | 含有Na2CO3的溶液:Al3+、Ca2+、Cl-、NO3- | |
| C. | 溶有大量Cl2的溶液:I-、SiO32-、K+、H+ | |
| D. | 25℃时pH<7的溶液:K+、Na+、Fe3+、NO3- |
| A | NaCl═Na++Cl-; NH3•H2O?NH4++OH- | 均属于电离方程式 |
| B | Ba2++SO42-═BaSO4↓; HCO3-+OH-═CO32-+H2O | 均可表示一类反应 |
| C | 向溶液中滴加盐酸酸化过的BaCl2溶液,出现白色沉淀 | 说明该溶液中一定有SO42- |
| D | Cl2+2NaOH═NaCl+NaClO+H2O; 3S+6NaOH═2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA | |
| B. | 1L1mol•L-1 的CaCl2溶液中含Cl-的数目为NA | |
| C. | 在标准状况下,22.4L H2O的质量约为18g | |
| D. | 22gCO2与标准状况下11.2LH2O含有相同的分子数 |
 某化学课外小组用如图装置制取溴苯.
某化学课外小组用如图装置制取溴苯.