题目内容
14.N2O4(g)?2NO2(g)(正反应为吸热反应),在1.01×105Pa、47℃时,N2O4分解率为40%,在1.01×105Pa、57℃时,N2O4分解率为50%,若在1.01×105Pa、47℃时,体积为2L的平衡混合物在保持压强不变的情况下升温至57℃并达到平衡,则平衡混合气体的体积是多少升?分析 假设N2O4(g)的起始体积为VL,47℃时到达平衡时转化的N2O4(g)的体积为0.4V L,表示出平衡时N2O4、NO2的体积,再根据混合气体总体积计算N2O4(g)的起始体积;
在1.01×105Pa、47℃时,体积为2L的平衡混合物在保持压强不变的情况下升温至57℃并达到平衡,可以等效为开始为VL的N2O4(g)在1.01×105Pa、57℃达到平衡,再根据57℃时N2O4分解率计算表示出平衡时N2O4、NO2的体积,可以计算混合气体总体积.
解答 解:假设N2O4(g)的起始体积为VL,47℃时到达平衡时转化的N2O4(g)的体积为VL×40%=0.4V L,则:
N2O4(g)?2NO2(g)
开始(L):V 0
转化(L):0.4V 0.8V
平衡(L):0.6V 0.8V
在1.01×105Pa、47℃时,平衡时混合气体的体积为2L,则0.6V+0.8V=2,解得V=$\frac{10}{7}$,
在1.01×105Pa、47℃时,体积为2L的平衡混合物在保持压强不变的情况下升温至57℃并达到平衡,可以等效为开始为VL的N2O4(g)在1.01×105Pa、57℃达到平衡,则转化的N2O4(g)的体积为$\frac{10}{7}$L×50%=$\frac{5}{7}$ L,则生成的NO2为$\frac{5}{7}$ L×2=$\frac{10}{7}$L,则平衡时混合气体体积为:($\frac{10}{7}$L-$\frac{5}{7}$ L)+$\frac{10}{7}$L=$\frac{15}{7}$L,
答:升温至57℃并达到平衡,则平衡混合气体的体积是$\frac{15}{7}$L.
点评 本题考查化学平衡有关计算,关键是等效平衡途径的构建,侧重考查学生分析解决问题的能力,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 氧化钙与水反应 | B. | 镁与盐酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | Ba(OH)2 和H2SO4反应 |
 如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化氢溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( )
如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化氢溶液,各加入生铁块,放置一段时间.下列有关描述错误的是( )| A. | 生铁块中的碳是原电池的正极 | |
| B. | 红墨水柱两边的液面变为左低右高 | |
| C. | 两试管中负极电极反应相同 | |
| D. | a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
| A. | NH4+、Ba2+、Cl-、NO3- | B. | Na+、K+、SO42-、NO3- | ||
| C. | Fe3+、Cu2+、SO42-、Cl- | D. | Cl-、K+、HCO3-、Al3+ |
| A. | 该烃有三种同分异构体 | |
| B. | 所得产物中,气体的物质的量是液体的1.2倍 | |
| C. | 该烃必有一种同分异构体的核磁共振氢谱有两组峰 | |
| D. | 该烃与2,6二甲基-3,5-二乙基-4-异丙基-庚烷是同系物 |
①SO2 ②乙烯 ③聚乙烯 ④乙炔 ⑤聚乙炔 ⑥FeSO4溶液 ⑦
 ⑧
⑧
| A. | ①②④⑤⑥⑧ | B. | ①②③④⑥⑧ | C. | ②③④⑤⑦⑧ | D. | ①②④⑥⑦ |
| A. | AlCl3 | B. | Na2O | C. | FeCl2 | D. | CuO |
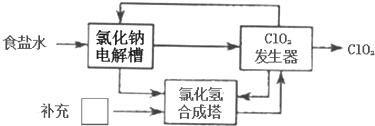
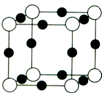 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题. .
.