题目内容
19.nLMgCl2溶液和nLNaCl溶液混合后(忽略体积变化),Cl-的物质的量浓度为3mol/L,则原MgCl2溶液和NaCl溶液的物质的量浓度不可能为( )| A. | 都是2mol/L | B. | 都是3mol/L | ||
| C. | 1.5mol/L和3mol/L | D. | 分别是1mol/L和4mol/L |
分析 nLMgCl2溶液和nLNaCl溶液混合后(忽略体积变化),Cl-的物质的量浓度为3mol/L,则:2c(MgCl2)×nL+c(NaCl)×nL=c(Cl-)×2nL,即2c(MgCl2)+c(NaCl)=6mol/L,结合选项验证判断.
解答 解:nLMgCl2溶液和nLNaCl溶液混合后(忽略体积变化),Cl-的物质的量浓度为3mol/L,则:2c(MgCl2)×nL+c(NaCl)×nL=c(Cl-)×2nL,即2c(MgCl2)+c(NaCl)=6mol/L,
A.都是2mol/L,满足2c(MgCl2)+c(NaCl)=6mol/L,故A符合;
B.都是3mol/L,2c(MgCl2)+c(NaCl)=9mol/L>6mol/L,故B不符合;
C.MgCl2溶液和NaCl溶液1.5mol/L和3mol/L,则2c(MgCl2)+c(NaCl)=6mol/L,故C符合;
D.MgCl2溶液和NaCl溶液分别是1mol/L和4mol/L,则2c(MgCl2)+c(NaCl)=6mol/L,故D符合,
故选:B.
点评 本题考查物质的量浓度计算,比较基础,关键是抓住溶液混合前后氯离子总的物质的量不变进行计算.

练习册系列答案
相关题目
7.将10.0g NaOH固体溶于水配成100ml.NaOH溶液,取出10mL,这10ml.溶液的物质的量浓度是( )
| A. | 2 mol•L-l | B. | 2.5 mol•L-l | C. | 0.2 mol•L-l | D. | 0.25 mol•L-l |
14.常温下,将Na2CO3溶液、Na2SO3和NaHCO3三种溶液混合,所得混合溶液中下列关系一定成立的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)>c(SO32-)>c(HSO3-) | |
| B. | c(Na+)>c(HCO3-)>c(CO32-)>c(SO32-)>c(OH-)>c(H+) | |
| C. | c(Na+)>[c(HCO3-)+c(CO32-)+c(H2CO3)+c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(HSO3-)+c(SO32-) |
4.下列反应属于吸热反应的是( )
| A. | 氧化钙与水反应 | B. | 镁与盐酸反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | Ba(OH)2 和H2SO4反应 |
8.下列说法不正确的是( )
| A. | 均三甲苯在核磁共振氢谱中能出现两组峰,且其峰面积之比为3:1 | |
| B. | 按系统命名法,化合物  的名称是2,2,4,5-四甲基-3,3-二乙基己烷 的名称是2,2,4,5-四甲基-3,3-二乙基己烷 | |
| C. | 乙醛和丙烯醛(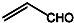 )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| D. | 一分子β-月桂烯(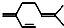 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 |