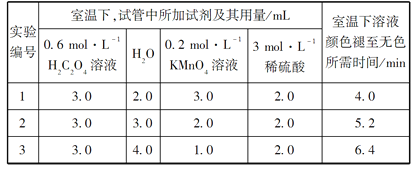
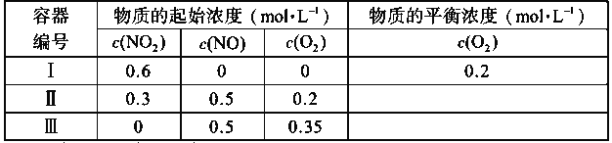
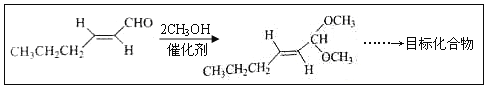
题目内容
【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=________mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).

① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、________________、_________________。
②试剂B是__________。
③ 操作③是_____________、_____________、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是__________________。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________________________。若将所得FeSO4·7H2O配成溶液,向溶液中滴加NaOH溶液的现象是_________________________________________________________________。
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是_________mol。
【答案】0.01 Fe +2Fe3+ = 3Fe2+ Fe +2H+ = Fe2+ +H2↑ 硫酸 蒸发浓缩 冷却结晶 取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽 FeSO4有还原性,易被氧化(或FeSO4·7H2O失去结晶水) 生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色 12
【解析】
(1)水溶液中,溶液呈电中性,即溶液中阴阳离子所带的电荷总数为零,在同一溶液中体积相等,2×10-3×3+1×10-3×2+2×10-3×1+c(H+)=1×10-2×2,则c(H+)=0.01mol/L;
(2)①向废水中加入铁粉后,首先三价铁离子与铁反应,然后为Fe + Cu2+ == Fe2+ + Cu 、最后为Fe +2H+ = Fe2+ +H2↑,答案为:Fe +2Fe3+ = 3Fe2+;Fe +2H+ = Fe2+ +H2↑;
②固体C为Fe、Cu的混合物,经过操作②过滤分离固体和液体,滤液回收,则试剂B为可溶解Fe,为酸,且阴离子为硫酸根离子,试剂B为硫酸;
③ 硫酸亚铁溶液经过操作③可得到硫酸亚铁晶体,则加热温度不能太高,可采用加热浓缩、冷却结晶、过滤的方法得到硫酸亚铁晶体;
④若溶液中含有Fe3+,加入硫氰化钾溶液后,显血红色,故答案为取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽;
⑤硫酸亚铁晶体中的亚铁离子不稳定,有还原性容易被空气中的氧气氧化变质,同时也很容易失去结晶水,亚铁离子与碱反应生成氢氧化亚铁,白色沉淀,被空气中的氧气氧化,迅速变为灰绿色,最终变为红褐色,答案为:FeSO4有还原性,易被氧化(或FeSO4·7H2O失去结晶水);生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色;
⑥1000l废水中含有Fe3+ 为 2mol,铁粉为10mol且过量,过量的在操作②中全部变为Fe2+,则溶液中的Fe2+ 的物质的量共计12mol,可获得 FeSO4·7H2O的物质的量是12mol。

【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____________,△H____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)=_____mol·L-1, C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为_____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_________;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_____________。
A(g)+B(g)的平衡常数的值为_____________。