题目内容
【题目】回答下列问题:
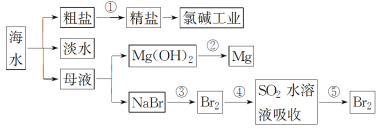
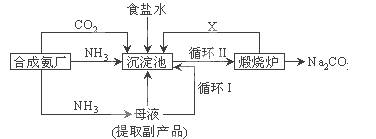
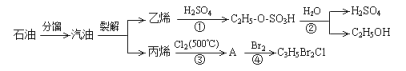
(1)过程①是为了除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,若要除去SO42-,则需要加入的试剂为_____________;若所加的该试剂过量,则可以被后加入的________________除去。
(2)过程②能否一步实现转化?______________(填“能”或“否”),Mg(OH)2与盐酸反应可以得到MgCl2溶液,则该反应的离子方程式为_____________________________________________。
(3)过程④反应的离子方程式为_____________________________________________________。
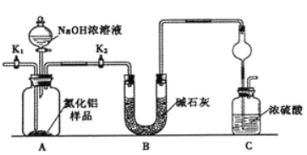
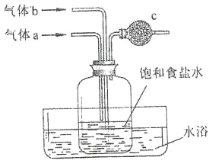
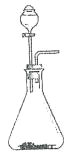
(4)若用CCl4萃取溴水中的Br2,分液时CCl4层应从分液漏斗的_____________放出。
【答案】BaCl2溶液 Na2CO3溶液 否 Mg(OH)2+2H+=Mg2++2H2O Br2+SO2+2H2O=SO42-+2Br-+4H+ 下口
【解析】
(1)根据分离提纯时不能引入新杂质结合硫酸根的性质分析解答;
(2)根据氢氧化镁、金属镁的性质判断;根据反应物和生成物书写方程式;
(3)根据溴水能氧化二氧化硫书写方程式;
(4)根据四氯化碳的密度大于水分析。
(1)由于不能引入新杂质,则要除去氯化钠溶液中的SO42-,则需要加入的试剂为BaCl2溶液;由于除去钙离子时需要加入碳酸钠,因此若所加的该试剂过量,则可以被后加入的Na2CO3溶液除去。
(2)镁是活泼的金属,氢氧化镁受热分解生成氧化镁和水,则过程②不能一步实现转化,Mg(OH)2与盐酸反应可以得到MgCl2溶液,同时还有水生成,则该反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O。
(3)溴水具有氧化性,能氧化二氧化硫,则过程④反应的离子方程式为Br2+SO2+2H2O=SO42-+2Br-+4H+。
(4)若用CCl4萃取溴水中的Br2,由于四氯化碳的密度大于水,则分液时CCl4层应从分液漏斗的下口放出。