题目内容
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____________,△H____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)=_____mol·L-1, C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为_____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_________;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_____________。
A(g)+B(g)的平衡常数的值为_____________。
【答案】[c(C)c(D)]/[c(A)c(B)] < 0.022 0.09 80% 80% c 2.5
【解析】
(1)A(g)+B(g)![]() C(g)+D(g)反应的平衡常数表达式为K=[c(C)c(D)]/[c(A)c(B)];700℃时,平衡常数为1.7,1000℃时,平衡常数为0.6,故温度越高,平衡常数越小,说明此反应为放热反应,即△H<0;
C(g)+D(g)反应的平衡常数表达式为K=[c(C)c(D)]/[c(A)c(B)];700℃时,平衡常数为1.7,1000℃时,平衡常数为0.6,故温度越高,平衡常数越小,说明此反应为放热反应,即△H<0;
(2)反应初始6s内A的平均反应速率v(A)=0.003molL-1s-1,则6s时△n(A)=0.003molL-1s-1×6s×5L=0.09mol,故A剩余物质的量为:n(A)=0.2mol-0.09mol=0.11mol,则6s时c(A)= ![]() =0.022mol/L,根据方程式可知,消耗A0.09mol时,生成C的物质的量为0.09mol;
=0.022mol/L,根据方程式可知,消耗A0.09mol时,生成C的物质的量为0.09mol;
设平衡时A的浓度变化量为x,则:
A(g)+B(g)![]() C(g)+D(g)
C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故![]() =1,解得x=0.032,所以平衡时A的转化率为
=1,解得x=0.032,所以平衡时A的转化率为![]() ×100%=80%,此时C的物质的量为0.032mol/L×5L=0.16mol;如果这时向该密闭容器中再充入1mol氩气,体积不变,平衡没有移动, A的转化率仍为80%;
×100%=80%,此时C的物质的量为0.032mol/L×5L=0.16mol;如果这时向该密闭容器中再充入1mol氩气,体积不变,平衡没有移动, A的转化率仍为80%;
(3) a.因气体反应物与生成物系数不变,压强始终不随时间改变 ,故a错误;
b.气体的质量不变,体积不变,气体的密度始终不变,故b错误;
c.c(A)不随时间改变,说明反应物或生成物的量一定,是平衡状态,故c正确;
d.单位时间里生成C和D的物质的量相等,此时不一定是平衡状态,故d错误,
答案为c;
(4)由图表知1200℃时反应A(g)+B(g)![]() C(g)+D(g)的平衡常数的值为0.4,则C(g)+D(g)
C(g)+D(g)的平衡常数的值为0.4,则C(g)+D(g)![]() A(g)+B(g)的平衡常数为
A(g)+B(g)的平衡常数为![]() =2.5。
=2.5。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=________mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).

① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、________________、_________________。
②试剂B是__________。
③ 操作③是_____________、_____________、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是__________________。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________________________。若将所得FeSO4·7H2O配成溶液,向溶液中滴加NaOH溶液的现象是_________________________________________________________________。
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是_________mol。
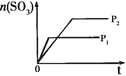
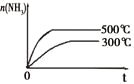
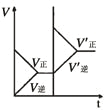
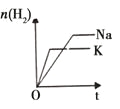
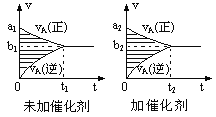
【题目】下列研究目的和示意图相符的是( )
① | ② | ③ | ④ | |
研 | 固定容积的密闭容器中,压强对反应: | 固定容积的密闭容器中,温度对反应: | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应: | 等质量Na、K 分别与足量水反应 |
示 |
|
|
|
|
A. ①B. ②C. ③D. ④