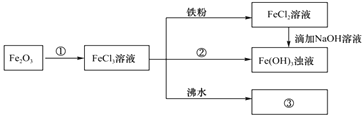
题目内容
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
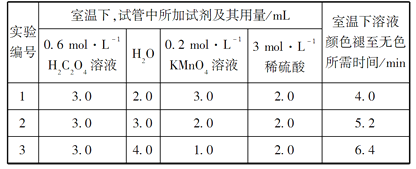
请回答:
(1)以上反应的化学方程式:__________________。
(2)根据上表中的实验数据,可以得到的结论是:_____________。
(3)利用实验1中数据计算,用KMnO4的浓度变化表示反应速率v(KMnO4)=_____。

(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①小组同学提出的假设是____________。
②请你帮助该小组同学完成实验方案_______。
【答案】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O 其他条件相同时,增大KMnO4浓度,反应速率加快 1.5×10-2 mol/(Lmin) 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) 保证其它条件与实验1相同,加入少量MnSO4固体,测定溶液褪色需要的时间
【解析】
(1)本题的实验原理是酸性高锰酸钾氧化草酸,酸性高锰酸钾褪色生成二价锰离子,草酸中的C被氧化为二氧化碳;
(2)从表中数据可知改变的条件是KMnO4浓度,根据高锰酸钾溶液浓度不同对反应速率的影响进行解答;
(3)先根据草酸和高锰酸钾的物质的量判断过量,然后根据反应速率表达式计算;
(4)①由图2可知反应开始一段时间后速率增大的比较快,结合影响化学反应速率的因素分析解答;②根据①的结论设计实验验证。
(1)本题的实验原理是酸性高锰酸钾氧化草酸,酸性高锰酸钾褪色生成二价锰离子,草酸中的C被氧化为二氧化碳,化学方程式为:2KMnO4+5H2C2O4+3H2SO4 ═K2SO4+2MnSO4+10CO2↑+8H2O,故答案为:2KMnO4+5H2C2O4+3H2SO4 ═K2SO4+2MnSO4+10CO2↑+8H2O;
(2)从表中数据可知改变的条件是KMnO4浓度,高锰酸钾的浓度越大,溶液褪色的时间越少,因此结论为:其他条件相同时,增大KMnO4浓度,反应速率加快,故答案为:其他条件相同时,增大KMnO4浓度,反应速率加快;
(3)实验1中草酸的物质的量为:0.6molL-1×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2molL-1×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol∶0.0006mol=3∶1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:![]() =0.06mol/L,用KMnO4的浓度变化表示反应速率v(KMnO4)=
=0.06mol/L,用KMnO4的浓度变化表示反应速率v(KMnO4)=![]() =1.5×10-2 mol/(Lmin),故答案为:1.5×10-2 mol/(Lmin);
=1.5×10-2 mol/(Lmin),故答案为:1.5×10-2 mol/(Lmin);
(4)①由图2可知反应开始一段时间后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,故答案为:生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②可以与实验1作对比实验,保证其它条件与实验1相同,加入少量MnSO4固体,若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂,故答案为:保证其它条件与实验1相同,加入少量MnSO4固体,测定溶液褪色需要的时间。

【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=________mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).

① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、________________、_________________。
②试剂B是__________。
③ 操作③是_____________、_____________、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是__________________。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________________________。若将所得FeSO4·7H2O配成溶液,向溶液中滴加NaOH溶液的现象是_________________________________________________________________。
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是_________mol。