题目内容
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g)![]() 2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
2NO(g)+O2(g)(正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
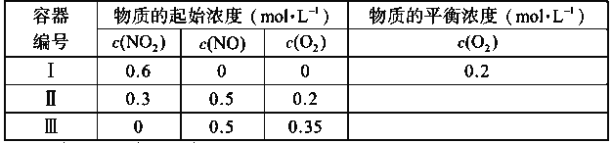
A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5
B.达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.达平衡时,容器Ⅲ中NO的体积分数小于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
【答案】CD
【解析】
A.I中反应三段式为

则该温度下平衡常数K=![]() =0.8;容器体积为1L,则平衡时I中气体总物质的量=1L×(0.2+0.4+0.2)mol/L=0.8mol,恒容恒温时气体压强之比等于其物质的量之比,如果平衡时I、II中压强之比为4:5,则II中平衡时气体总物质的量为1mol,而II中开始时各气体的总物质的量恰好为1mol,II中开始时浓度商=
=0.8;容器体积为1L,则平衡时I中气体总物质的量=1L×(0.2+0.4+0.2)mol/L=0.8mol,恒容恒温时气体压强之比等于其物质的量之比,如果平衡时I、II中压强之比为4:5,则II中平衡时气体总物质的量为1mol,而II中开始时各气体的总物质的量恰好为1mol,II中开始时浓度商=![]() =
=![]() ,则平衡正向移动,平衡正向移动导致混合气体总物质的量之和增大,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于 4:5,故A错误;
,则平衡正向移动,平衡正向移动导致混合气体总物质的量之和增大,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于 4:5,故A错误;
B.容器I中![]() =1;如果II中平衡时 c(NO2)=c(O2),设转化的 c(NO2)=xmol/L,则有0.3-x=0.2+0.5x,解得x=
=1;如果II中平衡时 c(NO2)=c(O2),设转化的 c(NO2)=xmol/L,则有0.3-x=0.2+0.5x,解得x=![]() mol/L,平衡时 c(NO2)=c(O2)=
mol/L,平衡时 c(NO2)=c(O2)=![]() mol/L,c(NO)=0.5mol/L+
mol/L,c(NO)=0.5mol/L+![]() mol/L=
mol/L=![]() mol/L,此时容器II中浓度商为
mol/L,此时容器II中浓度商为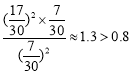 ,说明若容器II中c(NO2)=c(O2)时,平衡要逆向移动,则说明II中平衡时应该存在 c(NO2)>c(O2),即
,说明若容器II中c(NO2)=c(O2)时,平衡要逆向移动,则说明II中平衡时应该存在 c(NO2)>c(O2),即![]() <1,故B错误;
<1,故B错误;
C.平衡时I中NO的体积分数为![]() =50%;假设III中平衡时
=50%;假设III中平衡时
设III中NO的体积分数为50%时,转化的n(NO)=a,列三段式有:

则有![]() ,解得a=0.1mol,则此时容器中c(NO2)=0.1mol/L,c(NO)=0.4mol/L,c(O2)=0.3mol/L,此时容器中浓度商为
,解得a=0.1mol,则此时容器中c(NO2)=0.1mol/L,c(NO)=0.4mol/L,c(O2)=0.3mol/L,此时容器中浓度商为![]() ,所以此时平衡要逆向移动,即NO的体积分数要小于50%,故C正确;
,所以此时平衡要逆向移动,即NO的体积分数要小于50%,故C正确;
D.v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO)c(O2),达到平衡状态时正逆反应速率相等,则k正c2(NO2)=k逆c2(NO)c(O2![]() ,T2温度时k正=k逆,则K=1>0.8,该反应正反应为吸热反应,平衡常数变大说明温度升高,所以T2>T1,故D正确;
,T2温度时k正=k逆,则K=1>0.8,该反应正反应为吸热反应,平衡常数变大说明温度升高,所以T2>T1,故D正确;
故答案为CD。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=________mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).

① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、________________、_________________。
②试剂B是__________。
③ 操作③是_____________、_____________、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是__________________。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________________________。若将所得FeSO4·7H2O配成溶液,向溶液中滴加NaOH溶液的现象是_________________________________________________________________。
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是_________mol。
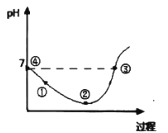
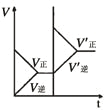
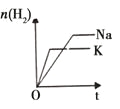
【题目】下列研究目的和示意图相符的是( )
① | ② | ③ | ④ | |
研 | 固定容积的密闭容器中,压强对反应: | 固定容积的密闭容器中,温度对反应: | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应: | 等质量Na、K 分别与足量水反应 |
示 |
|
|
|
|
A. ①B. ②C. ③D. ④