题目内容
1.(1)如图1是A、B、C三个烧杯中分别盛有相同物质的量浓度的稀盐酸.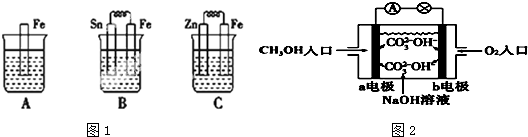
①B中Fe极的电极反应式为Fe-2e-=Fe2+.
②C中总反应化学方程式为Zn+2HCl═ZnCl2+H2↑.
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序B>A>C.
(2)如图2是甲醇燃料电池原理示意图,回答下列问题:
①电池的负极是a(填“a”或“b”),该极的电极反应是:CH3OH+8OH--6e-═CO32-+6H2O.
②电池工作一段时间后电解质溶液的碱性减小(填“增大”、“减小”或“不变”).
分析 (1)①B装置构成原电池,因为铁比锡活泼,所以Fe极为负极,据此书写反应式;
②C装置构成原电池,锌为负极,铁为正极,据此书写总反应化学方程式;
③A发生化学腐蚀,B中Fe为负极,Sn为正极,Fe被腐蚀,C中Zn为负极,Fe为正极,Fe被保护;
(2)①燃料电池中,负极上投放燃料,发生失电子发生氧化反应,正极上投放氧气,发生得电子的还原反应;
②根据该燃料电池工作时的总反应中消耗了电解质溶液中的氢氧根离子来回答.
解答 解:(1)①B装置构成原电池,因为铁比锡活泼,所以Fe极为负极,反应式为Fe-2e-=Fe2+;故答案为:Fe-2e-=Fe2+;
②C装置构成原电池,锌为负极,铁为正极,总反应化学方程式为Zn+2HCl═ZnCl2+H2↑;故答案为:Zn+2HCl═ZnCl2+H2↑;
③A发生化学腐蚀,B中Fe为负极,Sn为正极,Fe被腐蚀,C中Zn为负极,Fe为正极,Fe被保护,则A、B、C中铁被腐蚀的速率,由快到慢的顺序是B>A>C,
故答案为:B>A>C;
(2)①甲烷燃料电池中,通入氧气的b极为原电池的正极,发生得电子的还原反应,在碱性环境下,电极反应式为:2H2O+4e-+O2═4OH-,通入甲醇的a极为原电池的负极,发生失电子的氧化反应,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,
故答案为:a;CH3OH+8OH--6e-═CO32-+6H2O;
②根据电池的两极反应,在转移电子一样的情况下,消耗了溶液中的氢氧根离子,所以溶液的碱性减弱,pH减小,
故答案为:减小.
点评 本题考查了金属的腐蚀与防护以及甲醇燃料电池的工作原理知识,知道金属腐蚀快慢的判断方法,根据原电池原理正确书写反应式,题目难度不大.

练习册系列答案
相关题目
11.下列各组元素中,属于同一周期的是( )
| A. | Na、Li | B. | N、Cl | C. | Si、S | D. | O、P |
12.对于工业合成氨反应:N2+3H2$?_{催化剂}^{高温高压}$2NH3,下列说法错误的是( )
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以增大反应速率 |
6.在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
| A. | 原子序数:Z>Y>X>W | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | X元素最高价氧化物对应水化物的化学式为:H2XO3 | |
| D. | 四种元素的气态氢化物中,W的气态氢化物最稳定 |
13.下列叙述正确的是(( )
| A. | O2分子间存在着非极性共价键 | |
| B. | CO2分子内存在着极性共价键 | |
| C. | SO3与H2O反应的产物是离子化合物 | |
| D. | 盐酸中含有H+和Cl-,故HCl为离子化合物 |
10.下列有关项目的比较中,错误的是( )
| A. | 酸性:H2SiO3>H2CO3 | B. | 还原性:Na>Al | ||
| C. | 热稳定性:Na2CO3>NaHCO3 | D. | 熔点:SiO2>CO2 |
11.下列说法正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 由共价键形成的一定是共价化合物分子 | |
| D. | 只有非金属原子间才能形成共价键 |
 已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又
已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又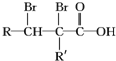 ,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).
,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).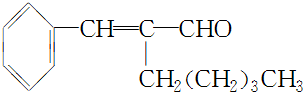 .
. +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH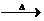
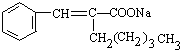 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.