题目内容
9. 已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又
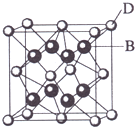
已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素.D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图.请回答:
(1)基态E3+离子核外有23种运动状态不同的电子.
(2)写出B的单质与水反应的离子方程式2F2+2H2O=4HF+O2 ;
(3)如图右所示,D跟B形成的离子化合物的化学式为CaF2;鉴别该离子化合物是否为晶体,最可靠的科学方法是X射线衍射法.
(4)A与B形成的化合物在气态时存在(AB)2二聚分子,原因是HF分子之间存在氢键;A与B形成的化合物比A与C形成的化合物熔点要高(填高或低)
分析 A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大,A与其它4种元素既不在同一周期又不在同一族,则A是H元素;
B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素,则E是Fe元素;
D的原子序数比E小6,则D是Ca元素;
D跟B可形成离子化合物其晶胞结构如图,该晶胞中B原子个数是8、D原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,B、D原子个数之比=8:4=2:1,钙离子带两个单位正电荷,所以B离子带一个单位负电荷,B和C同一主族且原子序数小于D,所以B是F、C是Cl元素,再结合物质结构性质解答.
解答 解:A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大,A与其它4种元素既不在同一周期又不在同一族,则A是H元素;
B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素,则E是Fe元素;
D的原子序数比E小6,则D是Ca元素;
D跟B可形成离子化合物其晶胞结构如图,该晶胞中B原子个数是8、D原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,B、D原子个数之比=8:4=2:1,钙离子带两个单位正电荷,所以B离子带一个单位负电荷,B和C同一主族且原子序数小于D,所以B是F、C是Cl元素,
(1)离子核外有几个电子,电子就有几种运动状态,基态Fe3+离子核外有23个电子,所以电子有23种运动状态,故答案为:23;
(2)B是F元素,其单质为氟气,氟气和水反应生成HF和氧气,反应方程式为2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2;
(3)根据以上分析知,B、D原子个数之比=8:4=2:1,所以其化学式为CaF2,可以利用X射线衍射法判断是否是晶体,故答案为:CaF2;X射线衍射法;
(4)HF中分子之间能形成氢键,所以A与B形成的化合物在气态时存在(AB)2二聚分子;HF中含有氢键、HCl中不含氢键,氢键的存在导致其熔沸点升高,所以熔沸点HF>HCl,
故答案为:HF分子间存在氢键;高.
点评 本题考查位置结构性质相互关系及应用,涉及氢键、晶胞计算、原子核外电子运动状态判断等知识点,这些都是高频考点,知道氢键对物质性质的影响,只影响物理性质不影响化学性质.

| A. | 若C为固体,则B一定是气体 | |
| B. | B和C一定都是气体 | |
| C. | 若起始时往容器中投入18gA,则反应吸收的热量为44.5kJ | |
| D. | 若起始时往容器中投入18gA,则反应放出的热量为44.5kJ |
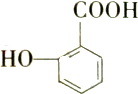 有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 | |
| B. | NH4+中4个N-H键的键能不相同 | |
| C. | N-O键的极性比C-O键的极性小 | |
| D. | 球棍模型  表示二氧化碳分子,也可以表示二氧化氮分子 表示二氧化碳分子,也可以表示二氧化氮分子 |
| A. | 蔗糖溶于水 | B. | 金刚石变成石墨 | C. | 氯化钠熔化 | D. | 水的汽化 |
| A. | 56g CO和32g O2所具有的总能量大于88g CO2所具有的总能量 | |
| B. | CO不如 CO2稳定 | |
| C. | 12g C所具有的能量一定高于28g CO所具有的能量 | |
| D. | 将一定质量的炭燃烧,生成CO2比生成CO时放出的热量多 |

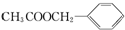 )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.
 发生反应④的化学方程式为
发生反应④的化学方程式为 ,该反应的反应类型为水解反应.
,该反应的反应类型为水解反应.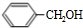 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$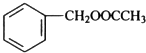 +H2O.
+H2O.