题目内容
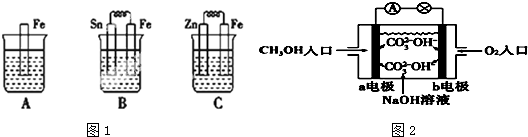
6.在周期表主族元素中,X元素位于第二周期,且分别与Y、Z、W三元素相邻,X、Y的原子序数之和等于Z的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )| A. | 原子序数:Z>Y>X>W | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | X元素最高价氧化物对应水化物的化学式为:H2XO3 | |
| D. | 四种元素的气态氢化物中,W的气态氢化物最稳定 |
分析 X元素位于第二周期,且分别与Y、Z、W三元素相邻,肯定有同主族元素,X、Y的原子序数之和等于Z的原子序数,二、三周期同主族元素的原子序数相差8,则X、Y中肯定有一种元素的原子序数为8,即O元素,如X为N,则Y为O,Z为P,三者原子的最外层电子数之和为5+5+6=16,则W为C,如X为O、则Y为F,Z为Cl,三者原子的最外层电子数之和为6+7+7=20,加上W的最外层电子,四种元素的最外层电子数之和大于20,不符合,则X为N,则Y为O,Z为P,W为C,以此解答该题.
解答 解:元素位于第二周期,且分别与Y、Z、W三元素相邻,肯定有同主族元素,X、Y的原子序数之和等于Z的原子序数,二、三周期同主族元素的原子序数相差8,则X、Y中肯定有一种元素的原子序数为8,即O元素,如X为N,则Y为O,Z为P,三者原子的最外层电子数之和为5+5+6=16,则W为C,如X为O、则Y为F,Z为Cl,三者原子的最外层电子数之和为6+7+7=20,加上W的最外层电子,四种元素的最外层电子数之和大于20,不符合,则X为N,则Y为O,Z为P,W为C,
A.X为N,则Y为O,Z为P,W为C,原子序数:Z>Y>X>W,故A正确;
B.这四种元素的单质多于6种:C可以是金刚石和石墨两种,N是氮气(N2),O是氧气(O2)和臭氧(O3),P是白磷(P4)和红磷,故B错误;
C.X为N,X元素最高价氧化物对应水化物的化学式为:HXO3,故C错误;
D.四种元素的气态氢化物中,Y为O,非金属性最强,则气态氢化物最稳定,故D错误.
故选A.
点评 本题考查原子结构、元素周期律知识,题目难度中等,注意根据元素在周期表中的位置以及原子结构特点正确推断元素的种类为解答该题的关键.

练习册系列答案
相关题目
17.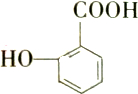 有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
 有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
11.下列关于乙炔制取的说法不正确的是( )
| A. | 为了加快反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 反应中不需加碎瓷片作沸石 | |
| D. | 为了除去杂质气体,除了用硫酸铜外还可用氢氧化钠溶液 |
18.在初中时我们就知道,有新物质生成的反应属于化学反应,但从化学键的观点看,化学反应的实质是“旧键的断裂,新键的形成”.据此你认为下列变化属于化学反应的是( )
| A. | 蔗糖溶于水 | B. | 金刚石变成石墨 | C. | 氯化钠熔化 | D. | 水的汽化 |
15.下列过程属于取代反应的是( )
| A. | 苯与碘水混合振荡,水层颜色变浅发生萃取 | |
| B. | 乙烯使溴水褪色 | |
| C. | 甲烷与氯气光照下反应 | |
| D. | 乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷 |
16.下列溶液中的离子反应表达正确的是( )
| A. | 将金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 大理石与醋酸的反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 三氯化铁溶液中加入铜粉:Cu+Fe3+═Cu2++Fe2+ | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
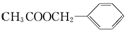 )广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.
)广泛存在于可可、咖啡、草莓等物质中,可用作食物和日化用品的香精.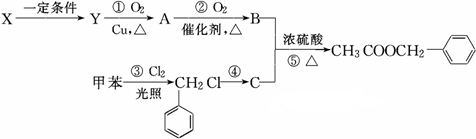
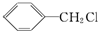 发生反应④的化学方程式为
发生反应④的化学方程式为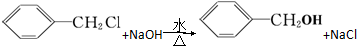 ,该反应的反应类型为水解反应.
,该反应的反应类型为水解反应.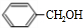 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$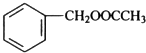 +H2O.
+H2O.