题目内容
12.对于工业合成氨反应:N2+3H2$?_{催化剂}^{高温高压}$2NH3,下列说法错误的是( )| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以增大反应速率 |
分析 A.催化剂能通过改变活化分子百分数而改变反应速率;
B.升高温度,通过改变活化分子百分数而改变反应速率;
C.该反应是可逆反应反应,有一定反应限度;
D.增大反应物浓度能增大反应速率.
解答 解:A.使用催化剂能增大活化分子百分数,从而增大反应速率,故A正确;
B.升高温度,增大活化分子百分数,从而增大反应速率,故B正确;
C.该反应是可逆反应反应,有一定反应限度,所以反应物一定不能完全转化为生成物,故C错误;
D.增大反应物浓度,增大单位体积内活化分子浓度,从而能增大反应速率,故D正确;
故选C.
点评 本题考查可逆反应、外界条件对化学反应速率的影响,明确浓度、温度、催化剂对反应速率影响原理是解本题关键,注意催化剂能改变反应速率但不影响平衡移动,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
2.X、Y、Z、M、R、Q是短周期主族元素,部分信息如表所示:
(1)R在元素周期表中的位置是第三周期ⅦA族;
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)Y与R相比,R非金属性较强,从原子结构角度解释原因:同周期自左而右,原子半径逐渐减小,得电子能力增强,非金属性增强,则非金属性Cl>Si;从实验事实角度解释,下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
d.将XR水溶液滴入Z2YM3溶液产生胶体
(4)根据表中数据推测,Y的原子半径的最小取值范围是大于0.099nm小于0.143nm.
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑.
(3)Y与R相比,R非金属性较强,从原子结构角度解释原因:同周期自左而右,原子半径逐渐减小,得电子能力增强,非金属性增强,则非金属性Cl>Si;从实验事实角度解释,下列事实能证明这一结论的是bc(选填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
d.将XR水溶液滴入Z2YM3溶液产生胶体
(4)根据表中数据推测,Y的原子半径的最小取值范围是大于0.099nm小于0.143nm.
3.铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2$\frac{\underline{\;高温\;}}{\;}$2PbO+2SO2;③制粗铅:PbO+C$\frac{\underline{\;高温\;}}{\;}$Pb+CO;PbO+CO$\frac{\underline{\;高温\;}}{\;}$Pb+CO2.下列说法正确的是( )
| A. | 浮选法富集方铅矿的过程属于化学变化 | |
| B. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| C. | 将1molPbS冶炼成Pb理论上至少需要6g碳 | |
| D. | 整个冶炼过程中,制取1molPb共转移2mol电子 |
20.密闭容器中的可逆反应3A(g)?3B+C,△H=+890kJ/mol(A的式量为120)随着温度升高,容器中气体平均相对分子质量减小,则下列判断正确的是( )
| A. | 若C为固体,则B一定是气体 | |
| B. | B和C一定都是气体 | |
| C. | 若起始时往容器中投入18gA,则反应吸收的热量为44.5kJ | |
| D. | 若起始时往容器中投入18gA,则反应放出的热量为44.5kJ |
7.下列说法正确的是( )
| A. | 分子晶体中分子间作用力越大,分子越稳定 | |
| B. | 硫酸氢钠溶于水时只破坏离子键 | |
| C. | 含有阳离子的晶体中一定有阴离子 | |
| D. | 1 mol二氧化硅晶体含4 mol Si-O键 |
17.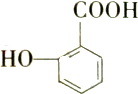 有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
 有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )
有多种同分异构体,其中能发生银镜反应,遇三氯化铁溶液发生显色反应,但不水解的芳香族化合物共有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
4.下列说法中正确的是( )
| A. | 乙烯中碳碳双键的键能是乙烷中碳碳单键的键能的2倍 | |
| B. | NH4+中4个N-H键的键能不相同 | |
| C. | N-O键的极性比C-O键的极性小 | |
| D. | 球棍模型  表示二氧化碳分子,也可以表示二氧化氮分子 表示二氧化碳分子,也可以表示二氧化氮分子 |
2.短周期元素离子aA2+、bB+、cC3+、dD- 都具有相同电子层结构,则下列叙述正确的是( )
| A. | 原子半径B>A>D | B. | 离子半径C>D>B>A | ||
| C. | 单质还原性A>B>D>C | D. | A、B、C、D可能是第二周期元素 |