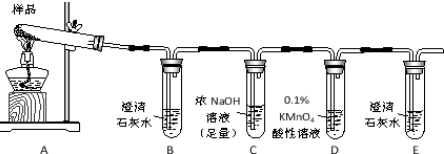
题目内容
2.下列四组物质中,均有一种物质的类别与其它三种不同.①MgO、Na2O、CO2、CuO
②NaHCO3、NaHSO4、NaNO3、NaHS
③NaOH、Na2CO3、KOH、SO2
④氯化钠溶液、硫酸铜溶液、氢氧化铁胶体、硫酸铁溶液
(1)四种物质依次是(填化学式):①CO2,②NaNO3,③SO2,④氢氧化铁胶体.
(2)写出②组中NaHCO3和NaHSO4反应的离子方程式:HCO3-+H+=CO2↑+H2O
(3)实验室制取氢氧化铁胶体应将饱和氯化铁溶液逐滴滴入沸水中,继续加热至红褐 色时,停止加热.
分析 (1)①MgO、Na2O、CuO均为碱性氧化物,而CO2为酸性氧化物;
②NaHCO3、NaHSO4、NaHS均为酸式盐,而NaNO3为正盐;
③NaOH、Na2CO3、KOH均为电解质,而SO2为非电解质;
④氯化钠溶液、硫酸铜溶液、硫酸铁溶液均为溶液,而氢氧化铁胶体为胶体分散系;
(2)二者反应生成硫酸钠和水、二氧化碳;
(3)饱和氯化铁溶液逐滴滴入沸水中,继续加热至出现红褐色液体,即得到胶体.
解答 解:(1)①MgO、Na2O、CuO均为碱性氧化物,而CO2为酸性氧化物;
②NaHCO3、NaHSO4、NaHS均为酸式盐,而NaNO3为正盐;
③NaOH、Na2CO3、KOH均为电解质,而SO2为非电解质;
④氯化钠溶液、硫酸铜溶液、硫酸铁溶液均为溶液,而氢氧化铁胶体为胶体分散系;
四组物质中,均有一种物质的类别与其它三种不同,分别为①CO2,②NaNO3,③SO2,④氢氧化铁胶体,
故答案为:CO2;NaNO3;SO2;氢氧化铁胶体;
(2)二者反应生成硫酸钠和水、二氧化碳,离子反应为HCO3-+H+=CO2↑+H2O,故答案为:HCO3-+H+=CO2↑+H2O;
(3)饱和氯化铁溶液逐滴滴入沸水中,继续加热至出现红褐色液体,即得到胶体,故答案为:红褐.
点评 本题考查物质的分类、离子反应及胶体制备等,综合性较强,把握相关概念及反应原理为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 在测定溶液的pH时,先用蒸馏水湿润,后用玻璃棒醮取溶液点在试纸中部,再与标准比色卡比较 | |
| B. | 某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- | |
| C. | 提纯含有少量Ba(NO3)2杂质的KNO3溶液,可以使用的方法为加入过量的K2CO3溶液,过滤除去沉淀,所得溶液中补加适量HNO3 | |
| D. | 实验过程中用不完的钠和白磷应直接扔到废液缸中 |
13.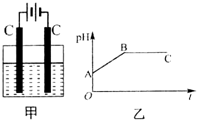 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
 甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )
甲装置中所含的是物质的量之比为1:2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应).试分析下列叙述中正确的是( )| A. | 是该混合溶液中的SO42-导致了A点溶液的pH值小于B点 | |
| B. | BC段阴极产物和阳极产物的体积之比为2:1 | |
| C. | AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu | |
| D. | 在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |
10.将金属钠分别投入下列物质的稀溶液中,有气体放出,且有白色沉淀生成的是( )
| A. | H2SO4 | B. | NaOH | C. | CuCl2 | D. | MgSO4 |
17.下列有关离子检验的操作和实验结论都正确的是
( )
| 选项 | 实验操作现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶液 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中滴入硝酸酸化硝酸银溶液产生白色沉淀 | 该溶液中一定含有Cl- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的五色气体 | 该溶液中一定含有CO${\;}_{3}^{2-}$ |
| D | 向某溶液中加入氯化钡溶液,产生白色沉淀,生成白色沉淀,将沉淀过滤后,在沉淀中加入稀盐酸,沉淀部分溶解,并产生无色无味能使澄清石灰水变浑浊的气体 | 该溶液中既有CO${\;}_{3}^{2-}$又有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
7.下列有关化学用语表达正确的是( )
| A. | H2O2的电子式: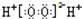 | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 乙酸分子的球棍模型: | |
| D. | 离子结构示意图 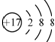 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
14.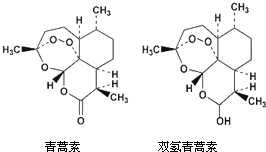 85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
 85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )| A. | 青蒿素和双氢青蒿素互为同分异构体 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素的分子式为C15H22O5 | |
| D. | 青蒿素分子中含有过氧链和酯基、醚键 |