题目内容
17.设NA为阿佛加德罗常数,下列说法不正确的是(相对原子质量 Na:23 O:16 H:1)( )| A. | 78gNa2O2固体中含有的阴离子数为2NA | |
| B. | 18g水中含有的电子数为10NA | |
| C. | 常温常压下,金属钠从水中置换出22.4LH2,发生转移的电子数小于2NA | |
| D. | 在1L2mol/L的硝酸铝溶液中含有的铝离子数为2NA |
分析 A、Na2O2由2个Na+和1个O22-构成;
B、根据n=$\frac{m}{M}$计算水的物质的量,每个水分子含有10个电子,根据N=nNA计算原子数目.
C、根据H元素化合价变化分析;
D、铝离子水解分析判断;
解答 解:A、78gNa2O2的物质的量n=$\frac{m}{M}$=$\frac{78g}{78g/mol}$=1mol,Na2O2由2个Na+和1个O22-构成,故1molNa2O2中含1mol阴离子,即NA个,故A错误;
B、18g水的物质的量为$\frac{18g}{18g/mol}$=1mol,每个水分子含有10个电子,所以18g水中含有的电子数为1mol×10×NAmol-1=10NA,故B正确;
C、标况下,22.4L氢气的物质的量为1mol,钠从盐酸中置换出1molH2,转移2mol电子,故发生转移的电子数为2NA,常温常压下,金属钠从水中置换出22.4LH2,发生转移的电子数小于2NA,故C正确;
D、在1L2mol/L的硝酸铝溶液中,铝离子物质的量应为1L×2mol/L=2MOL,但溶液中铝离子水解减小,含有的铝离子数小于2NA,故D错误;
故选AD.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积应用条件分析,物质的量和微粒数的计算分析,注意盐类水解的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.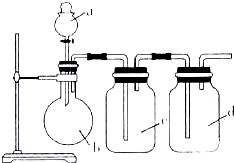 拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
 拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )
拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂).其中不能达到目的是( )| 选项 | 制取气体 | a | b | c | d |
| A | NO | 稀硝酸 | 铜片 | H2O | 浓硫酸 |
| B | O2 | 双氧水 | MnO2 | H2O | 浓硫酸 |
| C | NH3 | 浓氨水 | 碱石灰 | 浓硫酸 | H2O |
| D | SO2 | 浓盐酸 | Na2SO3粉末 | NaHSO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
8.下列实验方案合理的是( )
| A. | 制备乙炔:实验室不能用启普发生器来制取乙炔 | |
| B. | 制备乙酸乙酯:将乙醇和乙酸混合,再加入稀硫酸共热 | |
| C. | 制备一氯乙烷:将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 制备乙烯:实验室用无水乙醇和浓硫酸共热到170℃制取乙烯 |
5.下列各组中的离子能大量共存的是( )
| A. | NH4+、K+、Cl-、NO3- | B. | H+、NH4+、ClO-、SO42- | ||
| C. | H+、Na+、NO3-、SO32- | D. | Mg2+、Na+、Cl-、SO42- |
12.把金属A放入盐B(NO3)2的溶液中,发生如下反应:发生如下反应:A+B2+═A2++B,以下说法正确的是( )
| A. | 常温下金属A一定能与水反应,B一定不能与水反应 | |
| B. | A与B用导线连接后放入酒精中,一定形成原电池 | |
| C. | A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生 | |
| D. | 由A与B形成的原电池,A一定是负极,B一定是正极 |
9.设NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 0.1mol冰醋酸、0.1mol无水乙醇和浓硫酸混合加热后可得0.1NA个乙酸乙酯分子 | |
| B. | 0.1molL-1Na2SO4溶液中含2NA个Na+ | |
| C. | 2.7g的铝是足量的NaOH溶液充分反应,转移的电子数为0.3NA | |
| D. | 标准状况下,11.2升CCl4中所含的氯原子数目为2NA |
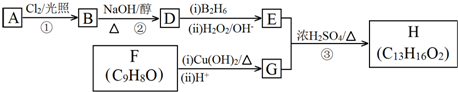
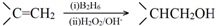
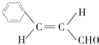 .
.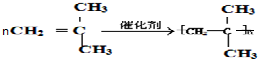 .
.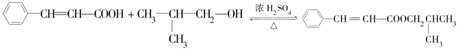 .
. .
.