题目内容
5.下列各组中的离子能大量共存的是( )| A. | NH4+、K+、Cl-、NO3- | B. | H+、NH4+、ClO-、SO42- | ||
| C. | H+、Na+、NO3-、SO32- | D. | Mg2+、Na+、Cl-、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A正确;
B.H+、ClO-结合生成弱电解质HClO,不能大量共存,故B错误;
C.H+、NO3-、SO32-发生氧化还原反应,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选AD.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
15.3个氨基酸失去2个H2O缩合成三肽化合物,现有分子式为C36H57O18N11的十一肽化合物完全水解生成甘氨酸(C2H5O2N)、丙氨酸(C3H7O2N)、谷氨酸(C5H9O4N),在缩合成十一肽化合物时,这三种氨基酸的物质的量之比为( )
| A. | 3:3:5 | B. | 3:5:3 | C. | 5:3:3 | D. | 8:7:7 |
16.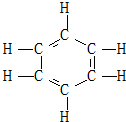 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )
1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )
①苯不能使溴的CCl4溶液褪色;②苯能与H2发生加成反应
③溴苯没有同分异构体 ④邻二溴苯只有一种.
 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )
1866年凯库勒提出了苯的单、双键交替的正六边形平面结构(如图),解释了苯的部分性质,但还有一些问题尚未解决,如它不能解释( )①苯不能使溴的CCl4溶液褪色;②苯能与H2发生加成反应
③溴苯没有同分异构体 ④邻二溴苯只有一种.
| A. | ①④ | B. | ④ | C. | ②③ | D. | ② |
13.下列离子方程式书写正确的是( )
| A. | 硅酸钠溶液中逐滴加入盐酸:Na2SiO3+2H+=H2SiO3↓+2Na2+ | |
| B. | 向氢氧化钠溶液中加入醋酸溶液:OH-+H+=H2O | |
| C. | 铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| D. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
20.德国人弗里茨•哈伯(Fritz Haber)由于发明了合成氨的方法而获得了1918年诺贝尔化学奖,他的发明大大提高了农作物的产量,同时也提高了硝酸、炸药的产量.下列有关说法正确的是( )
| A. | N2和H2在点燃或光照条件下合成氨 | |
| B. | 氨的稳定性比磷化氢弱 | |
| C. | 氨极易溶于水,氨水呈碱性,主要含 NH4+和OH- | |
| D. | 由氨制取硝酸铵的过程中,氨表现出还原性和碱性 |
10.阳离子X2+含中子N个,X的质量数为A,则a g X的同价氧化物中含质子的物质的量是( )
| A. | $\frac{a}{N}$(N-a)mol | B. | $\frac{a}{A+16}$(A-N+10)mol | C. | $\frac{a}{A+8}$(N+n)mol | D. | $\frac{a}{A+16}$(A-N+8)mol |
17.设NA为阿佛加德罗常数,下列说法不正确的是(相对原子质量 Na:23 O:16 H:1)( )
| A. | 78gNa2O2固体中含有的阴离子数为2NA | |
| B. | 18g水中含有的电子数为10NA | |
| C. | 常温常压下,金属钠从水中置换出22.4LH2,发生转移的电子数小于2NA | |
| D. | 在1L2mol/L的硝酸铝溶液中含有的铝离子数为2NA |
14.将锌片和铜片用导线连接置于同一稀硫酸中组成原电池,下列叙述不正确的是( )
| A. | 锌片发生氧化反应 | B. | 铜片发生还原反应 | ||
| C. | 铜片上有氢气析出 | D. | 电子从锌片流出,流向铜片 |
9.在下列各指定溶液中,离子可能大量共存的是( )
| A. | 澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- | |
| B. | 使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- | |
| C. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |