题目内容
4.若NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 在0℃、101 kPa时,22.4L氢气中含有NA个氢原子 | |
| B. | NA个CO分子和0.5mol CH4的质量比为7:4 | |
| C. | 16gCH4与18gNH${\;}_{4}^{+}$所含质子数相等 | |
| D. | 常温常压下,92g的NO2和N2O4混合气体中含有的原子数为6NA |
分析 A、在0℃、101 kPa时,气体摩尔体积为22.4L/mol;
B、NA个CO的物质的量为1mol,质量为28g;
C、分别求出两者的物质的量,然后根据甲烷和铵根离子中分别含10个质子和11个质子来分析;
D、NO2和N2O4的最简式均为NO2.
解答 解:A、在0℃、101 kPa时,气体摩尔体积为22.4L/mol,则22.4L氢气的物质的量为1mol,则含2NA个氢原子,故A错误;
B、NA个CO的物质的量为1mol,质量为28g;而0.5mol甲烷的质量为m=0.5mol×16g/mol=8g,则质量之比为28:8=7:2,故B错误;
C、16g甲烷和18g铵根离子的物质的量均为1mol,而甲烷和铵根离子中分别含10个质子和11个质子,故1mol甲烷和1mol铵根离子中含有的质子的物质的量分别为10mol和11mol,则个数不等,故C错误;
D、NO2和N2O4的最简式均为NO2,故92g混合物中含有的NO的物质的量为n=$\frac{92g}{46g/mol}$=2mol,则含6mol原子即6NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.为保护环境,洗涤含SO2的烟气.以下物质可作洗涤剂的是( )(填字母代号).
| A. | Ca(OH)2 | B. | CaCl2 | C. | Na2CO3 | D. | NaHSO3 |
15.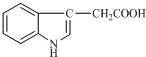 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
 1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )
1934年,科学家首先从人尿中分离出具有生长素效应的化学物质--吲哚乙酸,吲哚乙酸的结构如图所示.下列有关吲哚乙酸的说法中正确的是( )| A. | 吲哚乙酸与苯丙氨酸互为同分异构体 | |
| B. | 吲哚乙酸可以发生取代反应、加成反应、氧化反应和还原反应 | |
| C. | 1mol吲哚乙酸与足量氢气发生加成反应时,可以消耗5mol H2 | |
| D. | 吲哚乙酸苯环上的二氯代物共有四种结构 |
19.下列说法正确的是( )
| A. | 用分液漏斗分液时,先打开旋塞,待下层液体完全分出后,关闭旋塞,再从上口倒出上层液体 | |
| B. | 准确量取25.00 mL的液体可选用移液管、量筒或滴定管等量具 | |
| C. | 在中和热测定实验中,盐酸和NaOH溶液的总质量m g,反应前后体系温度变化,反应液的比热容为c J•g-1•℃-1,则生成1 mol水放出的热量为kJ | |
| D. | 在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸 |
12. 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温
度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只
投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
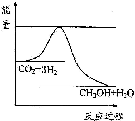
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1mol CO2 和3mol H2.
 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol
①该反应在高温下能自发进行的原因是△S>0
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是BDF(填字母,下同).
A.容器中的压强不变 B.1mol H-H 键断裂的同时断裂2mol H-O 键
C.V (CO)=V (H2)D.密闭容器的容积不再改变
E.消耗1mol 水的同时生成1mol H2 F.容器的密度不变
③该反应的平衡常数的表达式K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$.
(2)水煤气再进一步反应可制取氢气.反应为H2O(g)+CO(g)?H2(g)+CO2(g),某温
度下该反应的逆反应平衡常数K=$\frac{4}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中,只
投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断不正确的是B.
| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2的转化率不等
C.平衡时,丙中c(CO2)是甲中的2 倍
D.平衡时,乙中CO2的转化率大于60%
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L 的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)减小的是A.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1mol CO2 和3mol H2.
 如图是实验室中制备气体或验证气体性质的装置图
如图是实验室中制备气体或验证气体性质的装置图