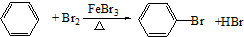题目内容
12.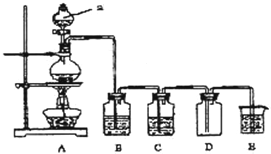 如图是实验室中制备气体或验证气体性质的装置图
如图是实验室中制备气体或验证气体性质的装置图(1)发生装置A中制取氯气的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)利用上图装置制备纯净的氯气,并证明氧化性:C12>Fe3+
则装置B中的溶液的作用是除去氯气中的氯化氢;装置D中加的最佳试剂是(填序号)d:供选试剂:a.浓H2SO4 b.FeCl2溶液 c.无水氯化钙 d.KSCN与FeCl2的混合溶液
(3)在图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和漂白性
实验2:证明碳元素的非金属性比硅元素的强
证明SO2具氧化性和漂白性:B中为少量Na2S溶液、C中加品红溶液,D中应加入足量的酸性高锰酸钾溶液(填溶液名称),E中加入Na2SiO3溶液(填化学式).
(4)证明碳元素的非金属性比硅元素的强的现象为D中高锰酸钾溶液不褪色,E中溶液变浑浊;实验2不严谨之处应如何改进
将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥.
分析 (1)A中加热二氧化锰与浓盐酸反应生成氯化锰、氯气和水;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质,据此分析B中溶液作用;根据实验目的选择试剂;
(3)根据元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利用强酸制弱酸来比较酸性强弱,根据CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去;
(4)根据CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去并再次通过酸性高锰酸钾溶液是否除尽;空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰.
解答 解:(1)A中加热二氧化锰与浓盐酸反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢杂质,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,可以用盛有饱和食盐除去氯气中的氯化氢;本实验目的之一为证明氧化性,氯气氧化二价铁离子生成三价铁离子,检验三价铁离子通常用硫氰酸钾,所以选:d;
故答案为:除去氯气中的氯化氢;d;
(3)元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利用碳酸的酸性强于硅酸,二氧化碳能与硅酸钠反应制得硅酸沉淀,由于CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,需要酸性高锰酸钾溶液除去,防止干扰检验二氧化碳;
故答案为:酸性高锰酸钾溶液,Na2SiO3;
(4)若D中高锰酸钾溶液不褪色,说明二氧化硫除尽,E中溶液变浑浊,说明含有二氧化碳气体;空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰,将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管可排除空气中二氧化碳的干扰,
故答案为:D中高锰酸钾溶液不褪色,E中溶液变浑浊;将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥.
点评 本题考查了氯气的制备及性质的检验,明确制备原理、熟悉装置特点及作用是解题关键,注意实验设计的严密性,题目难度不大.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | FeCl3 | B. | NaHCO3 | C. | MgSO4 | D. | Na2SO3 |
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(2)pH 相同的NaClO和CH3COOK溶液,其溶液的物质的量浓度的大小关系是:CH3COONa>NaClO,两溶液中:[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)](填“>”“<”或“=”).
(3)向 0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液 pH=5.
(4)碳酸钠溶液中滴加少量氯水的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-.
| A. | 水与四氯化碳 | B. | 食盐与泥沙 | C. | 硝酸钾与氯化钾 | D. | 溴与四氯化碳 |
| A. | 在0℃、101 kPa时,22.4L氢气中含有NA个氢原子 | |
| B. | NA个CO分子和0.5mol CH4的质量比为7:4 | |
| C. | 16gCH4与18gNH${\;}_{4}^{+}$所含质子数相等 | |
| D. | 常温常压下,92g的NO2和N2O4混合气体中含有的原子数为6NA |
| A. | 为了防止食品受潮及富脂食品氧化变质,常在包装袋中放入硅胶和硫酸亚铁( ) | |
| B. | 积极推行和使用能被微生物降解的新型聚合物材料 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 废旧电池应集中回收,不能填埋处理 |
 如图所示为实验室制取少量溴苯的装置,回答下列问题:
如图所示为实验室制取少量溴苯的装置,回答下列问题: