题目内容
11. 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=“4.18“J•(g•℃)-1.则该反应的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol(计算取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.所用硫酸为浓硫酸
c.环形玻璃搅拌棒改为铜质搅拌棒
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液.
分析 Ⅰ.(1)根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
Ⅱ.(1)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热,然后依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
③a.装置保温、隔热效果差,测得的热量偏小;
b.所用硫酸为浓硫酸,浓硫酸稀释放热,测得的热量偏大;
c.铜质搅拌棒导热,热量散失,测得的热量偏小;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小.
解答 解:Ⅰ.(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,故答案为:5.0;
Ⅱ.(1)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,第2数据舍去,其他三次温度差平均值=$\frac{4.0℃+3.9℃+4.1℃}{3}$=4.0℃,
故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-$\frac{1.3376KJ}{0.025mol}$=-53.5 kJ/mol,即稀强酸、稀强碱反应生成1mol液态水时放出53.5kJ热量,稀硫酸和氢氧化钠稀溶液反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol,
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol;
③a.装置保温、隔热效果差,测得的热量偏小,中和热数值偏小,故a正确;
b.所用硫酸为浓硫酸,浓硫酸稀释放热,测得的热量偏大,中和热数值偏大,故b错误;
c.铜质搅拌棒导热,热量散失,测得的热量偏小,中和热数值偏小,故c正确;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液,则参加反应的NaOH偏小,测得的热量偏小,中和热数值偏小,故d正确.
故答案为:acd.
点评 本题主要考查热化学方程式以及反应热的计算,题目难度不大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

| A. | 每个白藜芦醇分子中含有6个氢分子 | |
| B. | 白藜芦醇由碳、氢、氧三种元素组成 | |
| C. | 白藜芦醇的相对分子质量为228 | |
| D. | 白藜芦醇中碳、氢、氧三种元素的质量比为14:12:3 |
| A. | $\frac{1}{3}$mol | B. | $\frac{4}{3}$mol | C. | 1mol | D. | 2mol |
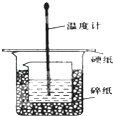 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如 图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)本实验中还缺少一个仪器,其名称是环形玻璃搅拌棒.在大小烧杯中填充泡沫塑料的作用是保温隔热,防止热量散失.
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录下原始数据(见表).
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的H偏大(填“偏大”、“偏小”或“不变”).
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热△H会偏大(填“偏大”、“偏小”或“不变”).
 学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:(1)通入氯气后,A中的现象是溶液变蓝色.C装置中发生反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-.
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.在答题卡上补充填写出实验步骤、预期现象和结论.
限选试剂及仪器:2mol/LHCl、2mol/LHNO3、1mol/LBaCl2溶液、lmol/LBa(NO3)2溶液、0.1mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
步骤1:取适量洗气瓶B中溶液于试管A中,滴加滴加过量2mol/LHCl(1分)和1mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加滴加入过量lmol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
步骤3:取步骤2后试管B中的上层清液于试管C中, 滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在氯离子. |
①配制250mL 溶液:取洗气瓶C中全部溶液准确配制250mL溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.1980mol/LKMnO4溶液装入酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应式:Fe2++MnO4-+H+-Fe3++Mn2++H2O,未配平)
③计算250mL溶液中FeCl2的物质的量=$\frac{250}{25.00}$×0.1980×V×10-3×5或10×0.1980×V×10-3×5mol(只列出算式,不做运算).
| A. | Zn为正极,碳为负极 | |
| B. | 负极反应为2NH4++2e-═2NH3↑+H2↑ | |
| C. | 工作时电子由碳极经外电路流向锌极 | |
| D. | 长时间连续使用时,内装的糊状物可能流出腐蚀电器 |