题目内容
3.日常所用的干电池,其电极分别为碳棒(上面有帽)和锌(皮),以糊状NH4Cl和ZnCl2作为电解质溶液(其中加入MnO2吸收H2),电极反应可简化为Zn-2e-═Zn2+,2NH4++2e-═2NH3↑+H2↑(NH3与Zn2+结合),根据上面叙述判断下列说法正确的是( )| A. | Zn为正极,碳为负极 | |
| B. | 负极反应为2NH4++2e-═2NH3↑+H2↑ | |
| C. | 工作时电子由碳极经外电路流向锌极 | |
| D. | 长时间连续使用时,内装的糊状物可能流出腐蚀电器 |
分析 A.原电池中,失电子的电极作负极,据此判断;
B.干电池工作时,负极上发生氧化反应;
C.电流从正极经外电路流向负极;
D.根据糊状物的性质分析,NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性.
解答 解:A、锌失电子而作负极,碳为正极,故A错误;
B、锌失电子而作负极,负极上发生氧化反应,电极反应为Zn-2e-═Zn2+,故B错误;
C、干电池工作时,电流从正极碳经外电路流向负极锌,故C错误;
D.NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性,所以干电池长时间连续使用时内装糊状物可能流出腐蚀电器,故D正确;
故选D.
点评 本题考查原电池原理,根据原电池正负极上得失电子来分析解答即可,难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
13.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)═C(石墨)△H=-1.9kJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
14.下列说法正确的是( )
| A. | 标准状况下1molSO3的体积为22.4L | B. | 标准状况下CO2的密度比SO2大 | ||
| C. | 1molSO42-的质量为94g | D. | 1molOH-含有10mol电子 |
11. 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①表中的温度差平均值为4.0℃
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=“4.18“J•(g•℃)-1.则该反应的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol(计算取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.所用硫酸为浓硫酸
c.环形玻璃搅拌棒改为铜质搅拌棒
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液.
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=“4.18“J•(g•℃)-1.则该反应的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-53.5kJ/mol(计算取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.所用硫酸为浓硫酸
c.环形玻璃搅拌棒改为铜质搅拌棒
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液.
15.下列有关酸、碱、盐的说法中,错误的是( )
| A. | 酸根中可能含有氧元素 | B. | 正盐中一定不含氢元素 | ||
| C. | 碱中一定含有氢元素和氧元素 | D. | 酸式盐中含有氢元素 |
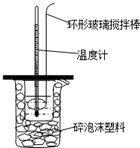 用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
 .
.