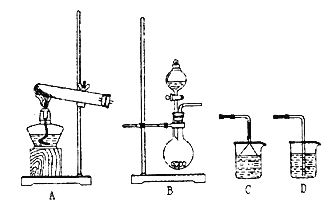
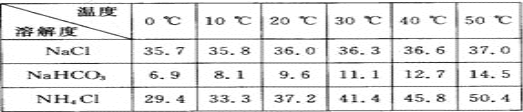
题目内容
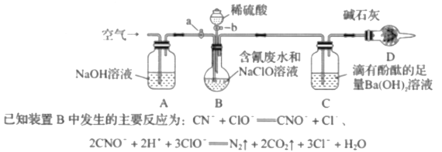
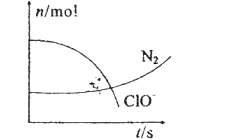
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是( )
A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5:2
D.若生成2.24LN2则转移电子1mol
【答案】AC
【解析】
由曲线变化图可知,随反应进行ClO﹣的物质的量降低,N2的物质的量增大,故ClO﹣为反应物,N2是生成物,根据电子转移相等可知,CN﹣是反应物,由氯元素守恒可知Cl﹣是生成物,由碳元素守恒可知HCO3﹣是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为﹣1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由﹣3价升高为0价,化合价升降最小公倍数为2[(4﹣2)+(3﹣0)]=10价,故CN﹣系数为2,ClO﹣系数为5,由元素守恒可知HCO3﹣系数为2,N2系数为1,Cl﹣系数为5,H2O系数为1,反应方程式为2CN﹣+5ClO﹣+H2O=2HCO3﹣+N2↑+5Cl﹣,以此来解答。
A.反应中,C元素化合价由CN﹣中+2价升高为HCO3﹣中+4价,N元素化合价由CN﹣中﹣3价升高为N2中0价,可知氧化产物有HCO3﹣、N2,故A正确;
B.反应中Cl元素化合价由ClO﹣中+1价降低为Cl﹣中﹣1价,ClO﹣是氧化剂,还原产物是Cl﹣,故B错误;
C.由上述分析可知,反应为2CN﹣+5ClO﹣+H2O=2HCO3﹣+N2↑+5Cl﹣,反应中是CN﹣是还原剂,ClO﹣是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,故C正确;
D.2.24LN2(标准状况)的物质的量为0.1mol,所以参加反应的ClO﹣的物质的量为0.5mol,反应中只有氯元素化合价降低,由ClO﹣中+1价降低为Cl﹣中﹣1价,所以转移电子为0.5mol×2=1mol,但状况未知,不能计算,故D错误;
故答案为AC。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】2019年诺贝尔化学奖授予美国和日本的三位科学家,以表彰他们在锂离子电池领域的贡献。某种锂离子电池的工作原理如图所示,工作原理为:LiCoO2+C6![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
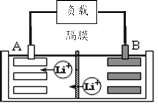
(1)该锂离子电池工作时A为____极,B的电极反应式为____。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过实验方法回收钴、锂,实现废旧电池的资源化。
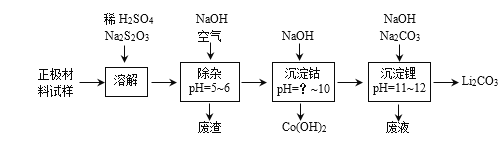
下表列出了几种离子生成氢氧化物沉淀的pH(“开始沉淀”的pH按金属离子浓度为0.1mol·L-1,“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1):
Al3+ | Fe3+ | Fe2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | ? |
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为____。
②除杂过程中,通空气将Fe2+氧化为Fe3+的目的是____。
③沉钴过程中,须调节溶液的pH不低于____。