题目内容
【题目】实验室制取氨气有几种方法。如图是实验室制气体的几种发生装置和吸收装置。
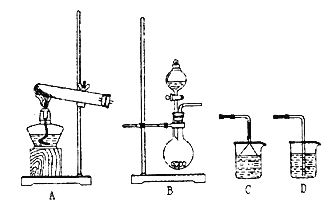
(1)当NH4Cl和Ca(OH)2来制取氨气时应选用的气体发生装置是___(填编号),该反应的化学方程式:___;
(2)①当用浓氨水和NaOH固体来制取氨气时应选用的气体发生装置是___(填编号)。
②欲用蒸馏水吸收氨气,应选择的吸收装置是所给装置中的___(填编号)
某化学课外兴趣小组探究铜跟浓硫酸反应情况。取6.4g铜片和10ml18mol/L浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时他们根据科学的化学知识认为还有较多的硫酸剩余。
(3)①请写出铜跟浓硫酸反应的化学方程式:___;
②可以证明有余酸的实验方案是(________)
A.再加入铁粉 B.再滴入BaCl2溶液 C.再加入银粉 D.再滴入NaHCO3
(4)某工厂以Cu与硝酸为原料制取Cu(NO3)2,设计了下列两个方案:
方案A:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
方案B:2Cu+O2=2CuO;CuO+2HNO3=Cu(NO3)2+H2O
回答:①你认为较合理的方案是___(填A或B)。
②选择该方案的原因____。
【答案】A 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O B C Cu+2H2SO4(浓)
CaCl2+2NH3↑+2H2O B C Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O AD B A中生成的NO会污染环境,生成相同质量的硝酸铜B方案需要的硝酸更少
CuSO4+SO2↑+2H2O AD B A中生成的NO会污染环境,生成相同质量的硝酸铜B方案需要的硝酸更少
【解析】
(1)依据反应物状态和反应条件分析判断制备气体的装置,A装置属于固固混合加热装置,反应是固体氯化铵和氢氧化钙加热反应生成氨气;
(2)浓氨水和NaOH固体反应生成氨气,B装置属于固液混合不加热型装置;氨气极易溶于水,处理时要用防倒吸装置;
(3)随反应进行硫酸浓度减小,稀硫酸和铜不反应,所以即使铜过量,硫酸也不能完全反应,因为浓硫酸和铜反应得到CuSO4,所以检验剩余的硫酸,不能检验硫酸根离子,需要检验剩余溶液中含H+;
(4)根据选择方案的依据和绿色化原理来回答本题。
(1) A装置属于固固混合加热装置,用NH4Cl和Ca(OH)2来制取氨气,反应物是固体和固体加热制备气体的反应,选用大试管加热制备氨气,选则装置A;用固体氯化铵和氢氧化钙加热反应生成氨气,反应的化学方程式:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:A;2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:A;2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)①NaOH溶于水放出热量,故致使溶于水的氨气溶解度降低,从而逸出,氨水为弱电解质存在电离平衡:NH3+H2ONH3H2ONH4++OH-,加入氢氧化钠,氢氧根浓度增大,平衡左移,氨气逸出,B装置属于固液混合不加热型装置,当用浓氨水和NaOH固体来制取氨气时应选用装置B,故答案为:B;
②氨气极易溶于水,处理时要用防倒吸装置,故答案为:C;
(3)①铜跟浓硫酸反应的化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
②随反应进行硫酸浓度减小,稀硫酸和铜不反应,所以即使铜过量,硫酸也不能完全反应,因为浓硫酸和铜反应得到CuSO4,所以检验剩余的硫酸,不能检验硫酸根离子,需要检验剩余溶液中含H+,H+和Fe反应放出氢气,和NaHCO3溶液反应得到二氧化碳,故答案为:AD;
(4)选择方案时要考虑是否产生有害气体污染空气,方案是否可行,是否安全,操作是否简单,是否节约了原料,方案A的生成物会污染环境,并且制取相同质量的硝酸铜,方案B消耗的原料最少,硝酸中的硝酸根全部转化成硝酸铜,故答案为:B;A中生成的NO会污染环境,生成相同质量的硝酸铜B方案需要的硝酸更少。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】某研究小组利用下图装置探究温度对氨气还原 Fe2O3 的影响(固定装置略)。完成下列填空:
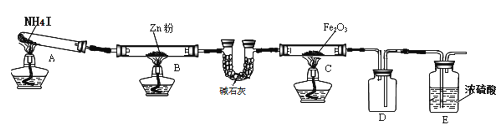
(1)实验时 A 中有大量紫红色的烟气,则 NH4I 的分解产物为 ___(至少填三种),E装置的作用是___。
(2)装置B中的反应方程式:______,D装置的作用是______。
某研究小组按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置 C 加热,反应产物均为黑色粉末(纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 变红 | 无现象 |
3 | 向步骤 2 溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(3)乙组得到的黑色粉末是______。
(4)甲组步骤1中反应的离子方程式为______。
(5)乙组步骤3中,溶液变红的原因为______;溶液褪色可能的原因及其验证方法为______。
(6)若装置C中Fe2O3反应后的产物是两种氧化物组成的混合物,为研究氧化物的组成,研究小组取样品7.84克在加热条件下通入氨气,完全反应后,停止加热,反应管中铁粉冷却后,称得质量为5.6克,则混合物的组成为______。
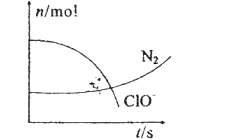
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气标准状况,实验记录如表累计值:
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积 | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5min)。反应开始后反应速率先增大的原因是__。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是__。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是__。
②该反应达到平衡状态的标志是__。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成2mol Z的同时生成3mol X