题目内容
20.下列说法正确的是( )| A. | 含有极性键的分子一定是极性分子 | |
| B. | 键能越大,表示该分子越容易受热分解 | |
| C. | 在分子中,两个成键的原子间的距离叫做键长 | |
| D. | H-Cl的键能为431.8KJ/mol,H-I的键能为298.7 KJ/mol,这可以说明HCl比HI分子稳定 |
分析 A.由极性键构成的分子,如果结构对称,正负电荷的中心重合,则为非极性分子,否则为极性分子;
B.键能越大,化学键越稳定,该分子越稳定,受热不易分解;
C.两个成键的原子间的核距离为键长;
D.键能越大,化学键越稳定;
解答 解:A.含有极性键的分子不一定是极性分子,如CO2含有极性键但属于非极性分子,故A错误;
B.键能越大,化学键越稳定,该分子越稳定,受热不易分解,故B错误;
C.两个成键的原子间的核距离为键长,故C错误;
D.键能越大,化学键越稳定,HCl的键能大,所以HCl分子比HI分子稳定,故D正确;
故选D.
点评 本题考查了键长、键能、极性键和非极性分子等概念的简单辨析,注意键的极性与分子极性的关系、分子的稳定性与键能之间的关系等知识点,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
10.下列热化学方程式或离子方程式中,正确的是( )
| A. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 如图表示H2与O2发生反应过程中的能量变化,H2的燃烧热为571.6 kJ•mol-1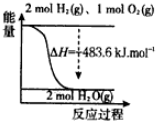 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
8.下列电子式书写正确的是( )
| A. | N2: | B. | NH3 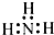 | C. | H2O H+[:O:]2-H+ | D. | NaCl  |
15.按如图装置进行实验(N装置中两个电极均为石墨棒),下列描述正确的是( )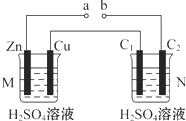

| A. | a、b连接,工作一段时间后装置M中溶液pH变大,装置N中溶液pH变小 | |
| B. | a、b连接,装置M中若有0.1 mol SO42-移到Cu电极,装置N中C2极放出H2 2.24 L(标准状况) | |
| C. | a、b未连接时,装置N中C1电极上有气体析出 | |
| D. | 不论a、b是否连接,装置M中观察到的实验现象相同 |
5.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子.下列有关这些元素性质的说法一定正确的是( )
| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Z元素的离子半径大于W元素的离子半径 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | Y元素的氧化物是含有极性键的非极性分子 |
9.下列气态氢化物的稳定性按逐渐减弱顺序排列的是( )
| A. | HI、HBr、HCl、HF | B. | HCl、H2S、PH3、SiH4 | ||
| C. | H2O、H2S、HCl、HBr | D. | HF、H2O、PH3、NH3 |
13.在同温同压下,相同体积的烧瓶分别充满氨气和氯化氢气体,做喷泉实验后,水都充满烧瓶,烧瓶中溶液的物质的量浓度之比是( )
| A. | 1:0.45 | B. | 1:1 | C. | 1:0.29 | D. | 4.5:2.9 |