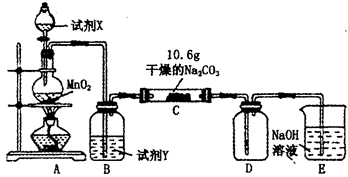
题目内容
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:

(1)操作1的名称为 。操作2用到的玻璃仪器有烧杯和
(2)“浸出”步骤中,为提高铜的浸出率,可采取的措施有
(3)比较操作2之前与操作3之后的溶液,说明两步骤主要目的是 。
(4)取少量所得溶液A,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)(不考虑除注明外的其它杂质干扰)
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL.
滴定反应:Cu2+ + H2Y2– CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
A.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
B.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
C.滴定前,滴定管尖端有气泡,滴定后气泡消失

(1)操作1的名称为 。操作2用到的玻璃仪器有烧杯和
(2)“浸出”步骤中,为提高铜的浸出率,可采取的措施有
(3)比较操作2之前与操作3之后的溶液,说明两步骤主要目的是 。
(4)取少量所得溶液A,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)(不考虑除注明外的其它杂质干扰)
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL.
滴定反应:Cu2+ + H2Y2–
 CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
A.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
B.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
C.滴定前,滴定管尖端有气泡,滴定后气泡消失
(1)过滤;分液漏斗
(2)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
(3)除去杂质、富集铜元素
(4)硫氰化钾 另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+(其他合理的答案也给分)
(5)5bc/4a
(6)C
(2)升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
(3)除去杂质、富集铜元素
(4)硫氰化钾 另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+(其他合理的答案也给分)
(5)5bc/4a
(6)C
试题分析:(1)根据流程图操作1是固液分离,名称为过滤;操作2不相溶的液体分离是分液,用到的玻璃仪器有烧杯和分液漏斗。
(2)主要从加快化学反应速率角度分析,可以是升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)。
(3)两步骤主要目的是除去杂质和富集铜元素。
(4)与Fe3+反应显红色的离子是硫氰化钾。要检验溶液中还存在Fe2+的方法是可利用其还原性进行检验,具体方法另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+。
(5) 20.00mLn(Cu2+)=n(H2Y2-)=bc×10-3mol,则ag试样中n(CuSO4?5H2O)=bc×10-3mol×5=5bc×10-3mol,m(CuSO4?5H2O)=5bc×10-3mol×250g/mol=1.25bcg,则CuSO4?5H2O质量分数为
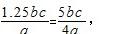
(6)a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中,对实验无影响,故a错误;b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定,会导致溶液浓度偏小,测定结果偏低,故b错误;c.滴定前,滴定管尖端有气泡,滴定后气泡消失,会导致体积偏大,测定结果偏大,故c正确,故答案为:c。

练习册系列答案
相关题目