题目内容
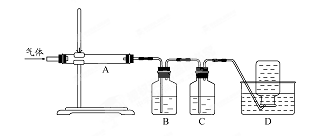
某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。
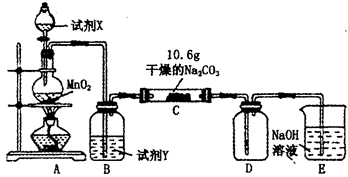
(1)A中制取Cl2的离子方程式_______________________________________.
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
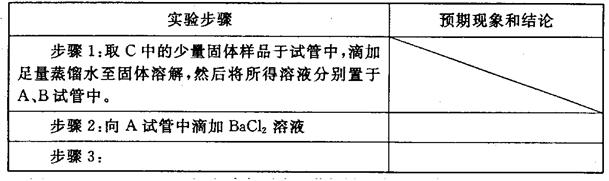
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为__________________。

(1)A中制取Cl2的离子方程式_______________________________________.
(2)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中只含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和_____________________________;
假设2:存在三种成分:NaHCO3和_____________________________。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。

(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为__________________。
(1)2Cl- + 4H+ + MnO2 Mn2+ + Cl2↑+ 2H2O;(2)①NaCl;NaCl和Na2CO3;②见解析;(3)2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O
Mn2+ + Cl2↑+ 2H2O;(2)①NaCl;NaCl和Na2CO3;②见解析;(3)2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O
 Mn2+ + Cl2↑+ 2H2O;(2)①NaCl;NaCl和Na2CO3;②见解析;(3)2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O
Mn2+ + Cl2↑+ 2H2O;(2)①NaCl;NaCl和Na2CO3;②见解析;(3)2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O试题分析:(1)实验室制备氯气,结合题给装置可知,是利用二氧化锰和浓盐酸加热反应生成氯气,反应的离子方程式为:2Cl- + 4H+ + MnO2
 Mn2+ + Cl2↑+ 2H2O;(2)①在装置C中通入一定量的氯气后,D中只有Cl2O一种气体,C中只含一种氯盐,且含有NaHCO3;假设存在两种成分,为NaHCO3和NaCl;假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3;②步骤2中向A试管中滴加适量BaCl2溶液的目的是检验产物中是否有Na2CO3,步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;答案为:
Mn2+ + Cl2↑+ 2H2O;(2)①在装置C中通入一定量的氯气后,D中只有Cl2O一种气体,C中只含一种氯盐,且含有NaHCO3;假设存在两种成分,为NaHCO3和NaCl;假设存在三种成分,应还有未完全反应的Na2CO3,即是NaHCO3、NaCl和Na2CO3;②步骤2中向A试管中滴加适量BaCl2溶液的目的是检验产物中是否有Na2CO3,步骤3应是检验氯离子,应向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液,若溶液变浑浊,证明固体中含有NaCl;答案为:| | 若无明显现象,证明固体中不含Na2CO3;若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
(3)根据题意知,C中发生的反应为:氯气、水与碳酸钠反应生成NaHCO3、NaCl和Cl2O,反应的化学方程式为:2Cl2+H2O+2Na2CO3═2NaHCO3+2NaCl+Cl2O。

练习册系列答案
相关题目
 Cr2O3)冶炼铬,简要流程如下:
Cr2O3)冶炼铬,简要流程如下:
 4Na2CrO4+Fe2O3+4CO2+______________。
4Na2CrO4+Fe2O3+4CO2+______________。
 的硫酸亚铁铵[ (NH4)2Fe(SO4)
的硫酸亚铁铵[ (NH4)2Fe(SO4) ]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。
]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。
 CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。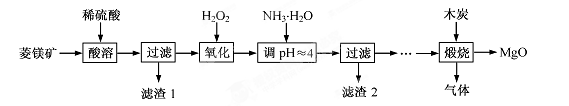
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑