题目内容
“天蓝蓝海蓝蓝,海边小城威海卫”。威海海水资源丰富,回答下列问题:
(1)海水中主要含有 等离子(写离子符号,至少答出4种)。
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法。其工艺流程如下图所示:

天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是: ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
(3)下图是海水综合利用的一个方面。

请回答下列问题:
I.①步主要反应的离子方程式: 。
溴及其化合物的用途有很多,写出其中的一种 。
II.第③步需要加入 ,其前面分离出氢氧化镁的操作称为 ,将镁条在二氧化碳中燃烧的产物为 。
III.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 正确的操作顺序是
(1)海水中主要含有 等离子(写离子符号,至少答出4种)。
(2)海水脱硫是一种有效除去火力发电产生的SO2的方法。其工艺流程如下图所示:

天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是: ;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是 。
(3)下图是海水综合利用的一个方面。

请回答下列问题:
I.①步主要反应的离子方程式: 。
溴及其化合物的用途有很多,写出其中的一种 。
II.第③步需要加入 ,其前面分离出氢氧化镁的操作称为 ,将镁条在二氧化碳中燃烧的产物为 。
III.粗盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤 正确的操作顺序是
(1)Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、I-、CO32-、HCO3-(2分)
(2)2H2SO3+O2=== 2H2SO4(1分)
中和、稀释经氧气氧化后海水中生成的酸(1分)
(3)I.2Br-+Cl2 ===2Cl-+Br2 (1分)
抗爆剂 感光材料 杀虫剂 镇静剂等(1分)
II. 盐酸(1分)过滤 (1分) MgO C(1分)
III.③②①⑤④或③①②⑤④(2分)
(2)2H2SO3+O2=== 2H2SO4(1分)
中和、稀释经氧气氧化后海水中生成的酸(1分)
(3)I.2Br-+Cl2 ===2Cl-+Br2 (1分)
抗爆剂 感光材料 杀虫剂 镇静剂等(1分)
II. 盐酸(1分)过滤 (1分) MgO C(1分)
III.③②①⑤④或③①②⑤④(2分)
试题分析:(1)海水中含有大量的离子,如:Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、I-、CO32-、HCO3-等
(2)SO2被海水吸收后生成H2SO3,被O2氧化为H2SO4,化学方程式为:2H2SO3+O2=== 2H2SO4;用大量的天然海水与之混合,可稀释中和、稀释经氧气氧化后海水中生成的硫酸。
(3)I.①步主要反应为氯气把Br?氧化为Br2,离子方程式为:2Br-+Cl2 ===2Cl-+Br2;溴及其化合物的用途为:抗爆剂 感光材料 杀虫剂 镇静剂等。
II.第③步把Mg(OH)2转化为MgCl2,所加试剂为盐酸;Mg(OH)2为沉淀,通过过滤可分离出Mg(OH)2;镁条在二氧化碳中燃烧生成MgO和C。
III.Na2CO3溶液可除去CaCl2和过量的BaCl2,NaOH溶液除去MgCl2,BaCl2溶液除去Na2SO4,BaCl2溶液的顺序应在Na2CO3溶液之后,所以正确的操作顺序是:③②①⑤④或③①②⑤④

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目

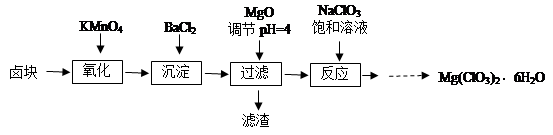

 CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。