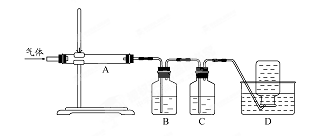
题目内容
已知滤渣2的主要成分是Fe(OH)3和Al(OH)3,由滤渣2制取Al2(SO4)3·18H2O,该探究小组设计了如下实验方案:

下列关于此方案的说法,错误的是

下列关于此方案的说法,错误的是
| A.加入NaOH溶液后过滤,滤渣为Fe(OH)3 |
| B.也可以先加硫酸,再加NaOH溶液后蒸发、冷却、结晶、过滤 |
| C.加硫酸后,溶液中的盐除含有硫酸铝外,还有硫酸钠 |
| D.如果滤渣2中含1molAl(OH)3,则至少需要1molNaOH才能使Al(OH)3完全溶解 |
B
试题分析:A、氢氧化铝是两性氢氧化物,能溶于强碱氢氧化钠溶液中,而氢氧化铁不溶,所以加入NaOH溶液后过滤,滤渣为Fe(OH)3,A正确;B、先进入稀硫酸,则生成硫酸铝和硫酸铁。再进入氢氧化钠溶液时生成氢氧化铁沉淀和偏铝酸钠,得不到硫酸铝,B不正确;C、根据原子守恒可知,加硫酸后,溶液中偏铝酸钠与稀硫酸反应生成的盐除含有硫酸铝外,还有硫酸钠,C正确;D、根据方程式Al(OH)3+NaOH=NaAlO2+2H2O可知,如果滤渣2中含1molAl(OH)3,则至少需要1molNaOH才能使Al(OH)3完全溶解,D正确,答案选B。

练习册系列答案
相关题目
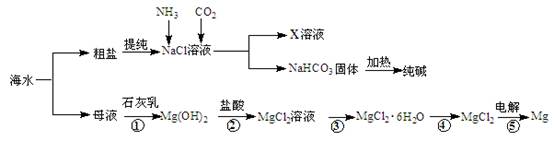
 Cr2O3)冶炼铬,简要流程如下:
Cr2O3)冶炼铬,简要流程如下:
 4Na2CrO4+Fe2O3+4CO2+______________。
4Na2CrO4+Fe2O3+4CO2+______________。
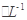 的硫酸亚铁铵[ (NH4)2Fe(SO4)
的硫酸亚铁铵[ (NH4)2Fe(SO4) ]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。
]滴定,终点时消耗b mL(此步骤的目的是用Fe2+把多余的Cr2O72-转化为)Cr3+。
 CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。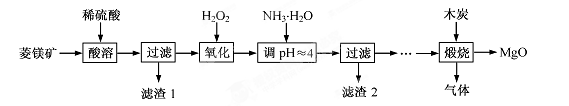
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑