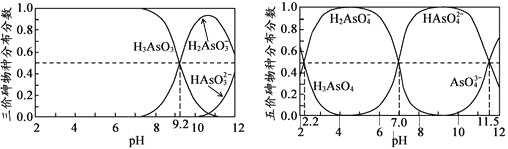
题目内容
【题目】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
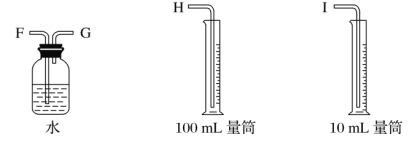
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接G-F-I,B接__________。
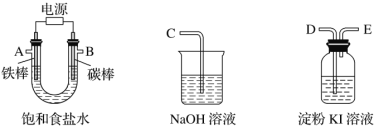
(2)铁棒接直流电源的________极;碳棒上发生的电极反应为_____________________________________。
(3)能说明氯气具有氧化性的实验现象是_______________________________________。
【答案】D、E、C 负极 2Cl——2e—=Cl2↑ 淀粉—KI溶液变成蓝色
【解析】
由电解产生的氢气的体积约6 mL和检验氯气的氧化性可知,铁棒作阴极,铁棒上产生的是氢气;碳棒作阳极,从B口导出的是氯气,碳棒上发生的电极反应为2Cl——2e—=Cl2↑。
(1)根据装置图可知碳棒是阳极,产生氯气。铁棒是阴极,产生的是氢气,可以通过排水法测量氢气的体积,由于氢气的体积约是6mL,所以选择10mL量筒。利用淀粉碘化钾检验氯气的氧化性,利用氢氧化钠溶液吸收多余的氯气,则正确的连接顺序是A 、G、F、I;B、D、E、C;
(2)铁棒是阴极,连接电源的负极,碳棒是阳极,氯离子放电,反应式为2Cl——2e—=Cl2↑;
(3)淀粉—KI溶液变成蓝色能说明氯气具有氧化性。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理________,哪些违反了洪特规则________。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(2)![]() 可用于制造火柴,其分子结构如图所示。
可用于制造火柴,其分子结构如图所示。

![]() 分子中硫原子的杂化轨道类型为________。
分子中硫原子的杂化轨道类型为________。
![]() 每个
每个![]() 分子中含有的孤电子对的数目为________。
分子中含有的孤电子对的数目为________。
(3)科学家合成了一种阳离子“![]() ”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“
”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“![]() ”的化学式为“
”的化学式为“![]() ”的离子晶体,其电子式为________。分子
”的离子晶体,其电子式为________。分子![]() 中键与键之间的夹角为
中键与键之间的夹角为![]() ,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为________________。
,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为________________。
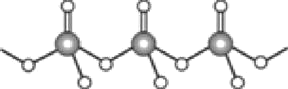
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为________。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和金属阳离子半径
碳酸盐 |
|
|
|
|
热分解温度 | 402 | 900 | 1172 | 1360 |
金属阳离子半径 | 66 | 99 | 112 | 135 |
随着金属阳离子半径的增大,碳酸盐的热分解温度逐步升高,原因是_____________。
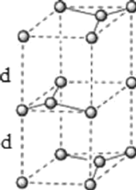
(6)石墨的晶体结构和晶胞结构如图所示。已知石墨的密度为![]() ,
,![]() 键的键长为
键的键长为![]() ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为![]() ,则石墨晶体的层间距为________cm。
,则石墨晶体的层间距为________cm。
 。
。