题目内容
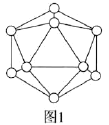
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH―= FeO42―+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO42―,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。回答下列问题:

(1)铁作________极,电极反应式为___________________________________________________。
(2)每制得1mol Na2FeO4,理论上可以产生标准状况 ____________ L 气体。
(3)电解一段时间后,c(OH―)降低的区域在_______________________(填“阴极室”或“阳极室”)。
(4)电解过程中,须将阴极产生的气体及时排出,其原因为_____________________。
(5)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析M点c(Na2FeO4)低于最高值的原因_______________________。
【答案】阳极 Fe- 6e- +8OH-![]() FeO42- + 4H2O 67.2L 阳极室 防止Na2FeO4与H2反应使产率降低 在M点c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低
FeO42- + 4H2O 67.2L 阳极室 防止Na2FeO4与H2反应使产率降低 在M点c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低
【解析】
(1)电解法制取有广泛用途的Na2FeO4,同时获得氢气,根据总反应:Fe+ 2H2O+ 2OH- ![]() FeO42-+3H2↑来回答;
FeO42-+3H2↑来回答;
(2) 根据总反应: Fe+ 2H2O+ 2OH- ![]() FeO42-+3H2↑来计算;
FeO42-+3H2↑来计算;
(3)根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少;
(4) 氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原.电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
(5)根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH -)低,Na2FeO4稳定性差,且反应慢,在N点 c(OH -)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。
(1)电解法制取有广泛用途的Na2FeO4,同时获得氢气,根据总反应:Fe+ 2H2O+ 2OH- ![]() FeO42-+3H2↑,所以金属铁是阳极,该电极上金属铁发生失电子的氧化反应,即Fe- 6e- +8OH-
FeO42-+3H2↑,所以金属铁是阳极,该电极上金属铁发生失电子的氧化反应,即Fe- 6e- +8OH-![]() FeO42- + 4H2O;
FeO42- + 4H2O;
(2)据总反应:Fe+ 2H2O+ 2OH- ![]() FeO42-+3H2↑,每制得1molNa2FeO4,理论上可以产生氢气3mol,即标准状况体积是3mol× 22.4L/mol= 67.2L;
FeO42-+3H2↑,每制得1molNa2FeO4,理论上可以产生氢气3mol,即标准状况体积是3mol× 22.4L/mol= 67.2L;
(3)根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH -)降低的区域在阳极室;
(4)氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
(5)根据题意Na2FeO4只在强碱性条件下稳定,在M点c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。

 阅读快车系列答案
阅读快车系列答案