题目内容
10.有原子序数依次增大的A、B、C、D、E五种短周期元主族素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
(1)甲的电子式
 ,丁的结构式
,丁的结构式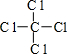
(2)E元素在周期表中的位置是第三周期ⅦA族,其最简单离子的结构示意图为
 ,最高价氧化物的水化物化学式为HClO4.
,最高价氧化物的水化物化学式为HClO4.(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是Al(填元素符号),并写出反应的离子方程式:2Al+6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 原子序数依次增大的A、B、C、D、E五种短周期主族元素,B原子最外层电子数比其次外层电子数多两个,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,原子序数小于碳,只能处于第一周期,可推知A为H元素;D和E位于同一周期,且D和E的原子序数之和为30,则二者处于第三周期,为Al与Cl或Si与S,且B、E形成的化合物丁在B:E=1:4,则D为Al、E为Cl;C是E的邻族元素,化学性质活泼,C的原子序数小于铝,则C为氧元素,可推知甲为H2O2,乙为C2H4,丙为AlCl3,丁为CCl4,据此解答.
解答 解:原子序数依次增大的A、B、C、D、E五种短周期主族元素,B原子最外层电子数比其次外层电子数多两个,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,二者不可能同周期,原子序数小于碳,只能处于第一周期,可推知A为H元素;D和E位于同一周期,且D和E的原子序数之和为30,则二者处于第三周期,为Al与Cl或Si与S,且B、E形成的化合物丁在B:E=1:4,则D为Al、E为Cl;C是E的邻族元素,化学性质活泼,C的原子序数小于铝,则C为氧元素,可推知甲为H2O2,乙为C2H4,丙为AlCl3,丁为CCl4,
(1)由上面的分析可知,甲为H2O2,电子式为 ,丁为CCl4,结构式为:
,丁为CCl4,结构式为: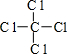 ,
,
故答案为: ;
;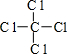 ;
;
(2)E为氯元素,位于周期表中第三周期ⅦA族,其最简单离子的结构示意图为 ,所以它的最高化合价为+7价,最高价氧化物的水化物化学式为HClO4,
,所以它的最高化合价为+7价,最高价氧化物的水化物化学式为HClO4,
故答案为:第三周期ⅦA族; ;HClO4;
;HClO4;
(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是Al,反应的离子方程式为:2Al+6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:Al;2Al+6H+=2Al3++3H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查经管系性质位置关系应用,侧重对化学用语的考查,元素推断是解题的关键,注意充分利用短周期主族元素进行推断,难度不大.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案 可简化为:
可简化为: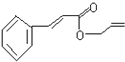 杀虫剂“阿乐丹”的结构表示为:
杀虫剂“阿乐丹”的结构表示为: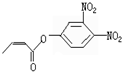 ,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )
,它在稀酸作用下能发生水解反应生成两种有机物.下列关于这两种有机物的共同性质叙述不正确的是( )| A. | 遇FeCl3溶液均显紫色 | B. | 均能发生氧化反应 | ||
| C. | 均能与溴水发生反应 | D. | 均能与NaOH溶液发生反应 |
| A. | ZnCl2既是氧化产物,又是还原产物 | |
| B. | ICl跟H2O的反应是自身氧化还原反应 | |
| C. | ZnI2既是氧化产物,又是还原产物 | |
| D. | 在ICl跟H2O的反应中,ICl是氧化剂,H2O是还原剂 |
| A. | R2O | B. | R2O2 | C. | RO2 | D. | R2O5 |
| A. | H2SeO3 | B. | HMnO4 | C. | H3BO3 | D. | H3PO4 |

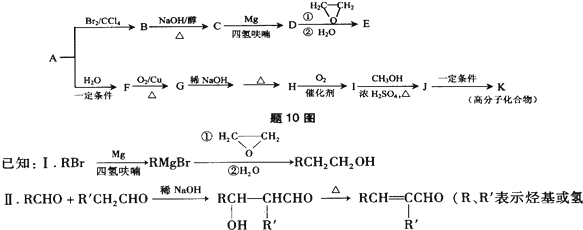
 .
. .
.
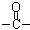 )外,含有的官能团名称是碳碳双键、酯基;
)外,含有的官能团名称是碳碳双键、酯基; .
.