ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΙΛ“Β…œ÷Τ»Γ±υΨß ·Θ®Na3AlF6Θ©ΒΡΜ·―ßΖΫ≥Χ Ϋ»γœ¬ΘΚ![]()
Άξ≥…œ¬Ν–ΧνΩ’ΘΚ
Θ®1Θ©Ζ¥”Π÷–ΥΡ÷÷‘ΣΥΊΕ‘”ΠΒΡΦρΒΞάκΉ”ΚΥΆβΒγΉ”≈≈≤ΦœύΆ§Θ§«κΑ¥άκΉ”ΑκΨΕ¥”¥σΒΫ–ΓΒΡΥ≥–ρ≈≈Ν–’βΥΡ÷÷άκΉ”____Θ§Τδ÷–‘≠Ή”–ρ ΐΉν¥σΒΡ‘ΣΥΊ‘≠Ή”ΚΥΆβ”–___÷÷ΡήΝΩ≤ΜΆ§ΒΡΒγΉ”Θ§ΤδΉνΆβ≤ψΒγΉ”ΒΡΒγΉ”‘Τ”–____÷÷≤ΜΆ§ΒΡ…λ’ΙΖΫœρΓΘ
Θ®2Θ©Ζ¥”Π÷–”–ΝΫ÷÷‘ΣΥΊ‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΈΜ÷ΟœύΝΎΘ§Ρή±»ΫœΥϋΟ«ΒΡΫπ τ–‘ΜρΖ«Ϋπ τ–‘«Ω»θΒΡ ¬ Β «____Θ®―ΓΧν±ύΚ≈Θ©ΓΘ
a. ΤχΧ§«βΜ·ΈοΒΡΈ»Ε®–‘ b. ΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·ΈοΒΡΥα–‘
c. ΒΞ÷ ”κ«βΤχΖ¥”ΠΒΡΡ―“Ή d. ΒΞ÷ ”κΆ§≈®Ε»ΥαΖΔ…ζΖ¥”ΠΒΡΩλ¬ΐ
Ζ¥”Π÷–ΝΫ÷÷Ϋπ τ‘ΣΥΊΘ§ΥϋΟ«ΒΡΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΒΡΥ°Μ·Έο÷°ΦδΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ_______ΓΘ
Θ®3Θ©±υΨß ·‘ΎΙΛ“Β…œΩ…ΉωΒγΫβ―θΜ·¬ΝΒΡ÷ζ»ήΦΝΘ§¥ΥΖ¥”Π÷–»τ”–0.6molΒγΉ”ΉΣ“ΤΘ§‘ρ‘Ύ____ΦΪΩ…ΒΟΫπ τ¬ΝΒΡ÷ ΝΩΈΣ_____ΩΥΓΘ
Θ®4Θ©ΙΛ“Β…œ≤Μ≤…”ΟΒγΫ⬻̷¬ΝΒΡΖΫΖ®Εχ «≤…”ΟΒγΫβ―θΜ·¬ΝΒΡΖΫΖ®ΜώΒΟ¬ΝΒΞ÷ ΒΡ‘≠“ρ «______ΓΘ
ΓΨ¥πΑΗΓΩO2-ΘΨF-ΘΨNa+ΘΨAl3+ 5 2 ac Al(OH)3+OH-=AlO2-+2H2O “θ 5.4 ¬»Μ·¬ΝΈΣΖ÷Ή”ΨßΧεΘ§‘Ύ»έ»ΎΉ¥Χ§œ¬≤ΜΡήΖΔ…ζΒγάκ
ΓΨΫβΈωΓΩ
Θ®1Θ©ΒγΉ”≤ψΫαΙΙœύΆ§Θ§ΚΥΒγΚ… ΐ‘Ϋ¥σάκΉ”ΑκΨΕ‘Ϋ–ΓΘΜ‘≠Ή”–ρ ΐΉν¥σΒΡΈΣAlΘ§≤ΜΆ§ΡήΦΕ÷–ΒΡΒγΉ”ΡήΝΩ≤ΜΆ§ΘΜΉνΆβ≤ψΈΣ3s23p1Θ§”–2÷÷ΒγΉ”‘ΤΘΜ
Θ®2Θ©Ζ¥”Π÷–ΝΫ÷÷‘ΣΥΊ‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΈΜ÷ΟœύΝΎΘ§ΈΣO‘ΣΥΊ”κΖζ‘ΣΥΊΘ§Ω…“‘ΗυΨί«βΜ·ΈοΈ»Ε®–‘ΓΔΒΞ÷ ”κ«βΤχΖ¥”ΠΡ―“Ή≥ΧΕ»±»ΫœΘ§OΓΔF‘ΣΥΊΟΜ”–Κ§―θΥαΘ§≤ΜΡή”ΟΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·ΈοΒΡΥα–‘Θ§ΒΞ÷ ”κΥαΖ¥”ΠΩλ¬ΐ≤ΜΡή±»ΫœΖ«Ϋπ τ–‘«Ω»θΘΜ
Θ®3Θ©«β―θΜ·ΡΤ”κ«β―θΜ·¬ΝΖ¥”Π…ζ≥…ΤΪ¬ΝΥαΡΤ”κΥ°ΘΜ
Θ®4Θ©ΒγΫβ≥Ί―τΦΪΖΔ…ζ―θΜ·Ζ¥”ΠΘ§“θΦΪΖΔ…ζΜΙ‘≠Ζ¥”ΠΘ§Εχ¬ΝάκΉ”ΖΔ…ζΜΙ‘≠Ζ¥”ΠΘ§”Π‘Ύ“θΦΪΈω≥ωΘΜΗυΨίΒγΉ”ΉΣ“Τ ΊΚψΦΤΥψAlΒΡΈο÷ ΒΡΝΩΘ§ΫχΕχΦΤΥψAlΒΡ÷ ΝΩΘΜ
Θ®5Θ©¬»Μ·¬ΝΈΣΙ≤ΦέΜ·ΚœΈοΘ§ΨßΧε÷–≤Μ¥φ‘ΎάκΉ”Θ§»έ»Ύ ±≤ΜΡήΒΦΒγΓΘ
(1)O2ΓΔFΓΔNa+ΓΔAl3+ΒγΉ”≤ψΫαΙΙœύΆ§,ΚΥΒγΚ… ΐ‘Ϋ¥σάκΉ”ΑκΨΕ‘Ϋ–Γ,Ι άκΉ”ΑκΨΕΘΚO2>F>Na+>Al3+;‘≠Ή”–ρ ΐΉν¥σΒΡΈΣAl,ΚΥΆβΒγΉ”≈≈≤ΦΈΣ1s22s22p63s23p1,≤ΜΆ§ΡήΦΕ÷–ΒΡΒγΉ”ΡήΝΩ≤ΜΆ§,ΚΥΆβ”–5÷÷≤ΜΆ§ΡήΝΩΒΡΒγΉ”;ΉνΆβ≤ψΈΣ3s23p1,”–2÷÷ΒγΉ”‘Τ,Ι ¥πΑΗΈΣΘΚO2>F>Na+>Al3+ΘΜ5ΘΜ2ΘΜ
(2)Ζ¥”Π÷–ΝΫ÷÷‘ΣΥΊ‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΈΜ÷ΟœύΝΎΘ§ΈΣO‘ΣΥΊ”κΖζ‘ΣΥΊΘ§
a. «βΜ·Έο‘ΫΈ»Ε®Θ§Ζ«Ϋπ τ–‘‘Ϋ«ΩΘ§aœν’ΐ»ΖΘΜ
b. OΓΔF‘ΣΥΊΟΜ”–Κ§―θΥαΘ§≤ΜΡή”ΟΉνΗΏΦέ―θΜ·ΈοΕ‘”ΠΥ°Μ·ΈοΒΡΥα–‘Θ§bœν¥μΈσΘΜ
c.ΒΞ÷ ”κ«βΤχΖ¥”Π‘Ϋ»ί“ΉΘ§Ε‘”Π‘ΣΥΊΒΡΖ«Ϋπ τ–‘‘Ϋ«ΩΘ§cœν’ΐ»ΖΘΜ
d.ΒΞ÷ ”κΆ§≈®Ε»ΥαΖΔ…ζΖ¥”ΠΒΡΩλ¬ΐ≤ΜΡή≈–ΕœΖ«Ϋπ τ–‘«Ω»θΘ§»γ―θΤχ”κœθΥα≤ΜΖ¥”ΠΘ§ΕχSΓΔΒβ”κœθΥαΖ¥”ΠΘ§dœν¥μΈσΘ§
Ι ―ΓΘΚacΘΜ
(3)«β―θΜ·¬Ν «ΝΫ–‘«β―θΜ·Έο,ΡήΚΆ«β―θΜ·ΡΤΖ¥”Π,Ζ¥”ΠάκΉ”ΖΫ≥Χ ΫΈΣΘΚAl(OH)3+OH=AlO2+2H2OΘ§
Ι ¥πΑΗΈΣΘΚAl(OH)3+OH-=AlO2-+2H2OΘΜ
(4)ΒγΫβ≥Ί―τΦΪΖΔ…ζ―θΜ·Ζ¥”Π,“θΦΪΖΔ…ζΜΙ‘≠Ζ¥”Π,Εχ¬ΝάκΉ”ΖΔ…ζΜΙ‘≠Ζ¥”Π,”Π‘Ύ“θΦΪΈω≥ω;ΗυΨίΒγΉ”ΉΣ“Τ ΊΚψ,Έω≥ωAlΒΡΈο÷ ΒΡΝΩΈΣ![]() =0.2molΘ§Ι Έω≥ωAlΒΡ÷ ΝΩΈΣ0.2molΓΝ27g/mol=5.4gΘ§
=0.2molΘ§Ι Έω≥ωAlΒΡ÷ ΝΩΈΣ0.2molΓΝ27g/mol=5.4gΘ§
Ι ¥πΑΗΈΣΘΚ“θΘΜ5.4ΘΜ
(5)“ρΈΣ¬»Μ·¬ΝΈΣΙ≤ΦέΜ·ΚœΈοΘ§ τ”ΎΖ÷Ή”ΨßΧεΘ§ΨßΧε÷–≤Μ¥φ‘ΎάκΉ”Θ§»έ»Ύ ±≤ΜΡήΒΦΒγΘ§Ι ≤ΜΡή±ΜΒγΫβΘΜΕχ―θΜ·¬ΝΈΣάκΉ”Μ·ΚœΈοΘ§»έ»ΎΉ¥Χ§Ω…“‘ΒΦΒγΘ§
Ι ¥πΑΗΈΣΘΚ¬»Μ·¬ΝΈΣΖ÷Ή”ΨßΧεΘ§‘Ύ»έ»ΎΉ¥Χ§œ¬≤ΜΡήΖΔ…ζΒγάκΓΘ

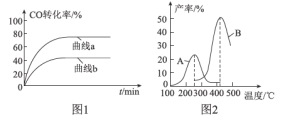
ΓΨΧβΡΩΓΩ«βΤχ «“Μ÷÷«εΫύΡή‘¥ΓΘΩ…”…COΚΆΥ°’τΤχΖ¥”Π÷Τ±ΗΘ§ΤδΡήΝΩ±δΜ·»γœ¬ΆΦΥυ ΨΓΘ

(1)ΗΟΖ¥”ΠΈΣΩ…ΡφΖ¥”ΠΓΘ‘Ύ800 Γφ ±Θ§»τCOΒΡΤπ Φ≈®Ε»ΈΣ2.0 molΓΛL-1Θ§Υ°’τΤχΒΡΤπ Φ≈®Ε»ΈΣ3.0 molΓΛL-1Θ§¥οΒΫΜ·―ßΤΫΚβΉ¥Χ§ΚσΘ§≤βΒΟCO2ΒΡ≈®Ε»ΈΣ1.2 molΓΛL-1Θ§‘ρ¥ΥΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣ___Θ§ΥφΉ≈Έ¬Ε»…ΐΗΏΗΟΖ¥”ΠΒΡΜ·―ßΤΫΚβ≥Θ ΐΒΡ±δΜ·«ς Τ «___ΓΘΘ®ΧνΓΑ±δ¥σΓ±ΓΔΓΑ±δ–ΓΓ±ΜρΓΑ≤Μ±δΓ±Θ©
(2)Ρ≥Έ¬Ε»œ¬Θ§ΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣK=1/9ΓΘΗΟΈ¬Ε»œ¬‘ΎΦΉΓΔ““ΓΔ±ϊ»ΐΗωΚψ»ίΟή±’»ίΤς÷–ΆΕ»κH2O(g)ΚΆCO(g)Θ§ΤδΤπ Φ≈®Ε»»γœ¬±μΥυ ΨΓΘœ¬Ν–≈–Εœ≤Μ’ΐ»ΖΒΡ «____(ΧνΉ÷ΡΗ)ΓΘ
Τπ Φ≈®Ε» | ΦΉ | ““ | ±ϊ |
c(H2O)/molΓΛL-1 | 0.010 | 0.020 | 0.020 |
c(CO)/molΓΛL-1 | 0.010 | 0.010 | 0.020 |
A. Ζ¥”ΠΩΣ Φ ±Θ§±ϊ÷–ΒΡΖ¥”ΠΥΌ¬ ΉνΩλΘ§ΦΉ÷–ΒΡΖ¥”ΠΥΌ¬ Ήν¬ΐ
B. ΤΫΚβ ±Θ§ΦΉ÷–ΚΆ±ϊ÷–H2OΒΡΉΣΜ·¬ Ψυ «25%
C. ΤΫΚβ ±Θ§±ϊ÷–c(CO2) «ΦΉ÷–ΒΡ2±ΕΘ§ «0.015 molΓΛL-1
D. ΤΫΚβ ±Θ§““÷–H2OΒΡΉΣΜ·¬ ¥σ”Ύ25%
(3)“ΜΕ®ΧθΦΰœ¬Θ§Ω…ΡφΖ¥”ΠN2(g)+3H2(g)![]() 2NH3(g)ΓΓΠΛH<0Θ§¥οΒΫΤΫΚβΚσΘΚ
2NH3(g)ΓΓΠΛH<0Θ§¥οΒΫΤΫΚβΚσΘΚ
ΔΌΦ”¥ΏΜ·ΦΝΘ§v(’ΐ)ΓΔv(Ρφ)ΕΦΖΔ…ζ±δΜ·Θ§«“±δΜ·ΒΡ±Ε ΐ__(ΧνΓΑœύȖΜρΓΑ≤ΜœύȖ)ΓΘ
ΔΎΥθ–ΓΧεΜΐ ΙΧεœΒ―Ι«Ω‘ω¥σΘ§‘ρv(’ΐ)___Θ§v(Ρφ)___(ΧνΓΑ‘ω¥σΓ±ΓΔΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±)Θ§v(’ΐ)±δΜ·ΒΡ±Ε ΐ__v(Ρφ)±δΜ·ΒΡ±Ε ΐ(ΧνΓΑ¥σ”ΎΓ±ΓΔΓΑ–Γ”ΎΓ±ΜρΓΑΒ»”ΎΓ±)ΓΘ
ΔέΫΒΈ¬Θ§v(’ΐ) ____Θ§v(Ρφ)__(ΧνΓΑ‘ω¥σΓ±ΓΔΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±)ΓΘ
ΔήΈ¬Κψ―ΙΘ§‘ΌΆ®»κ“ΜΕ®ΝΩΒΡHeΘ§¥οΒΫ–¬ΤΫΚβ ±Θ§N2ΒΡΉΣΜ·¬ __Θ§c(H2)ΫΪ__(ΧνΓΑ‘ω¥σΓ±ΓΔΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±)ΓΘ