��Ŀ����
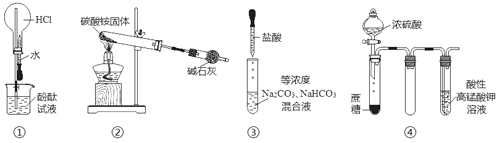
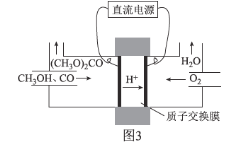
����Ŀ��ij��ȤС���������ͼ��ʾ��ʵ��װ�ã��ȿ�������ȡ���壬�ֿ�������֤���ʵ����ʡ�
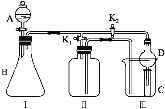
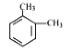
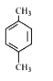
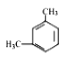
��1����K1�ر�K2������ȡijЩ���塣��ͬѧ��Ϊװ�â��������ȡH2��NH3��O2����װ�â�ֻ���ռ�H2��NH3�������ռ�O2����������_____����ͬѧ��Ϊ�ڲ��Ķ�װ�â�������ǰ���£���װ�â�����ʵ��Ľ���Ҳ���ռ�O2������Ϊ���ĸĽ�������_____��
��2����K2�ر�K1���ܱȽ�һЩ���ʵ����ʡ���ͬѧ���ʵ��Ƚ������ԣ�KClO3��Cl2��Br2����A�м�Ũ�����һ��ʱ�䣬�۲쵽C�е�������______������D�ڸ�װ���е�������_______����Bװ���з�����Ӧ�����ӷ���ʽΪ______����ͬѧ��ʯ��ʯ�����ᡢ�����Ƶ�ҩƷ�������һʵ�顣����ʵ��Ŀ����_____��
��3��ʵ���ҳ���ŨH2SO4�������Ʒ�Ӧ��ȡHNO3������װ�������ʺ���ȡHNO3����_____��ʵ����������Ũ����ķ�����_______��
a  b
b  c
c 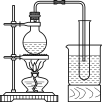 d
d 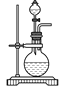
���𰸡��������ܶȱȿ����� ��װ�â���װ��ˮ ��Һ�ʳ�ɫ ��ֹ���� ClO3��+6H++5Cl��=3Cl2��+3H2O �Ƚϴ��ᡢ̼��ͱ��ӵ�����ǿ����ʵ֤���ԣ�CH3COOH��H2CO3��C6H5OH�� b ʢװ�ڴ�����������ɫϸ�ڲ���ƿ�У����������������������µĵط���
��������
��1�������ܶȱȿ��������ſ������ռ������������ſ������ռ�����װ���н����̣ܶ������ܳ���Ϊ�����ſ�����������ˮ�������ռ�O2�����壻
��2��װ�â���֤���ʵ�����(K2��K1�ر�)������������+��ԭ��=��������+��ԭ��������ԣ�������>���������ԭ�ԣ���ԭ��>��ԭ�����Ҫ���ʵ��֤��������KClO3>Cl2>Br2����I�з���KClO3��Ũ�����������ԭ��Ӧ�����з���������NaBr��������ԭ��Ӧ���л������õ�װ���ܷ�ֹ��������Bװ����KClO3��-1�۵������������������·���������ԭ��Ӧ��������������ǿ�������ᣬʯ��ʯ�ʹ��ᷴӦ���ɶ�����̼��������̼�ͱ����Ʒ�Ӧ���ɱ��ӣ��ݴ˷���ʵ��Ŀ�ģ�
(3)�ٸ��ݻ�ѧ��Ӧԭ�����������ȡԭ���ǣ������Һ������ȡ���ѻӷ��Ե�������ȡ�ӷ��Ե��ᣬ�ݴ�ѡ��װ�ã�
�ڸ������������ѡ����ʵ����淽�����������ֽ⣬����ʱ���ܼ��⣬�����¼��ɷֽ⣬��Ҫ���±��档
��1����ͬѧ����װ���н����̣ܶ������ܳ���Ϊ�����ſ�������O2���ܶȴ��ڿ������ܶȣ�������Ӧ���������ſ������ռ�����ͬѧ��O2������ˮ������Ӧ������������ˮ�������ܲ�����ˮ���ռ������ԸĽ������ǽ�װ�â���װ��ˮ��
�ʴ�Ϊ���������ܶȱȿ�����װ�â���װ��ˮ��
��2������������+��ԭ��=��������+��ԭ��������ԣ�������>���������ԭ�ԣ���ԭ��>��ԭ�����Ҫ���ʵ��֤��������KClO3>Cl2>Br2��װ�â���֤���ʵ�����(K2��K1�ر�)����I�з���KClO3��Ũ�����������ԭ��Ӧ�����з���������NaBr��������ԭ��Ӧ����������Ϊ������>���������A��ΪŨ���ᣬB��ΪKClO3���壬C��ΪNaBr��Һ���۲쵽C�е�����Ϊ��Һ�ʳ�ɫ������DΪ����ܣ��л������ã������ܷ�ֹ��������Bװ������������Ӻ������������������·�����̬���з�Ӧ������������ӦΪ��ClO3��+6H++5Cl��=3Cl2��+3H2O��ʯ��ʯ�ʹ��ᷴӦ���ɶ�����̼��������̼�ͱ����Ʒ�Ӧ���ɹ������������B�й����ܽ⣬������ɫ���壬C�Թ��в�����ɫ������ʵ���Ŀ���DZȽ�̼�ᡢ���ᡢ���ӵ�����ǿ��(ʵ֤���ԣ�CH3COOH��H2CO3��C6H5OH)��
�ʴ�Ϊ����Һ�ʳ�ɫ����ֹ������ ClO3��+6H++5Cl��=3Cl2��+3H2O���Ƚϴ��ᡢ̼��ͱ��ӵ�����ǿ��(ʵ֤���ԣ�CH3COOH��H2CO3��C6H5OH)��
(3)���������ȡԭ���ǣ������Һ������ȡ����d���÷�Ӧ�����ѻӷ��Ե�������ȡ�ӷ��Ե��ᣬ�����ӷ����������ſ������ռ�����a��c������������Ļӷ���ע����ѡ����ռ�������bװ����ʾ��
�ʴ�Ϊ��b��
�ڴ����������Ũ�����ڳ����¼�������Ⱦͻ�ֽ����ɶ���������������ˮ������ʱ��Ҫ������ʹ����ɫ���Լ�ƿ��
�ʴ�Ϊ��ʢװ�ڴ�����������ɫϸ�ڲ���ƿ�У�������������(�������µĵط�)��

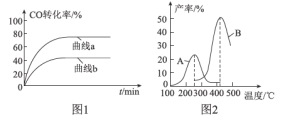
����Ŀ��������һ�������Դ������CO��ˮ������Ӧ�Ʊ����������仯����ͼ��ʾ��

(1)�÷�ӦΪ���淴Ӧ����800 ��ʱ����CO����ʼŨ��Ϊ2.0 mol��L-1��ˮ��������ʼŨ��Ϊ3.0 mol��L-1���ﵽ��ѧƽ��״̬���CO2��Ũ��Ϊ1.2 mol��L-1����˷�Ӧ��ƽ�ⳣ��Ϊ___�������¶����߸÷�Ӧ�Ļ�ѧƽ�ⳣ���ı仯������___�������������������С��������������
(2)ij�¶��£��÷�Ӧ��ƽ�ⳣ��ΪK=1/9�����¶����ڼס��ҡ������������ܱ�������Ͷ��H2O(g)��CO(g)������ʼŨ�����±���ʾ�������жϲ���ȷ����____(����ĸ)��
��ʼŨ�� | �� | �� | �� |
c(H2O)/mol��L-1 | 0.010 | 0.020 | 0.020 |
c(CO)/mol��L-1 | 0.010 | 0.010 | 0.020 |
A. ��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������
B. ƽ��ʱ�����кͱ���H2O��ת���ʾ���25%
C. ƽ��ʱ������c(CO2)�Ǽ��е�2������0.015 mol��L-1
D. ƽ��ʱ������H2O��ת���ʴ���25%
(3)һ�������£����淴ӦN2(g)+3H2(g)![]() 2NH3(g)����H<0���ﵽƽ���
2NH3(g)����H<0���ﵽƽ���
�ټӴ�����v(��)��v(��)�������仯���ұ仯�ı���__(��������������������)��
����С���ʹ��ϵѹǿ������v(��)___��v(��)___(����������������С������������)��v(��)�仯�ı���__v(��)�仯�ı���(��������������С��������������)��
�۽��£�v(��) ____��v(��)__(����������������С������������)��
���º�ѹ����ͨ��һ������He���ﵽ��ƽ��ʱ��N2��ת����__��c(H2)��__(����������������С������������)��