题目内容
8.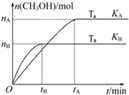 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:(1)TA<TB(选填“>”“=”或“<”,下同),△H<0,
KA>KB.
(2)若容器容积不变,下列措施可增加CH3OH产率的是BD(填写序号).
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入0.10mol H2和0.05mol CO
(3)反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将正向(选填“逆向”“正向”或“不”)移动,化学平衡常数K不变(选填“增大”“减小”或“不变”).
(4)在TB下反应达到平衡,平衡时的压强为开始的0.9倍,CO的转化率为15%.
(5)在TA下反应达到平衡,混合气体的平均相对分子质量为$\frac{64}{3}$,则平衡混合气体中H2的体积分数为33.3%.
分析 (1)温度越高,反应速率越快,到达平衡时间越短,由图可知,温度TB先到达平衡,则温度TA<TB,升高温度,甲醇的物质的量减小,说明平衡逆向移动,平衡常数减小,而升高温度平衡向吸热反应方向移动;
(2)A.升高温度,平衡逆向移动;
B.将CH3OH(g)从体系中分离,平衡正向移动;
C.充入He,使体系总压强增大,恒容条件下,反应体系各组分浓度不变,平衡不移动;
D.再充入0.10mol H2和0.05mol CO,等效为在原平衡基础上增大压强,平衡正向移动;
(3)反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,压强增大,平衡向气体体积减小的方向移动;化学平衡常数只受温度影响,温度不变,平衡常数不变;
(4)恒温恒容下,压强之比等于其物质的量之比,平衡时混合气体总物质的量为(1mol+2mol)×0.9=2.7mol,利用差量法计算参加反应CO物质的量,进而计算CO转化率;
(5)混合气体总质量等于起始时CO与氢气质量之和,故平衡时混合气体物质的量为$\frac{1mol×28g/mol+2mol×2g/mol}{\frac{64}{3}g/mol}$=1.5mol,利用差量法计算参加反应氢气物质的量,再计算平衡体系中氢气体积分数.
解答 解:(1)温度越高,反应速率越快,到达平衡时间越短,由图可知,温度TB先到达平衡,则温度TA<TB,升高温度,甲醇的物质的量减小,说明平衡逆向移动,平衡常数减小,平衡常数KA>KB,而升高温度平衡向吸热反应方向移动,故正反应为放热反应,则△H<0,
故答案为:<;<;>,
(2)A.升高温度,平衡逆向移动,甲醇的产率减小,故A错误;
B.将CH3OH(g)从体系中分离,平衡正向移动,甲醇产率增大,故B正确;
C.充入He,使体系总压强增大,恒容条件下,反应体系各组分浓度不变,平衡不移动,甲醇产率不变,故C错误;
D.再充入0.10mol H2和0.05mol CO,等效为在原平衡基础上增大压强,平衡正向移动,甲醇产率增大,故D正确,
故选:BD;
(3)反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,压强增大,由于正反应为气体体积减小的反应,故平衡向正反应方向移动,化学平衡常数只受温度影响,温度不变,平衡常数不变,
故答案为:正向;不变;
(4)恒温恒容下,压强之比等于其物质的量之比,平衡时混合气体总物质的量为(1mol+2mol)×0.9=2.7mol,则:
CO(g)+2H2(g)?CH3OH(g) 物质的量减小△n
1 2
0.15mol 3mol-2.7mol=0.3mol
故CO转化率为$\frac{0.15mol}{1mol}$×100%=15%,
故答案为:15%;
(5)混合气体总质量等于起始时CO与氢气质量之和,故平衡时混合气体物质的量为$\frac{1mol×28g/mol+2mol×2g/mol}{\frac{64}{3}g/mol}$=1.5mol,则:
CO(g)+2H2(g)?CH3OH(g) 物质的量减小△n
2 2
1.5mol 3mol-1.5mol=1.5mol
故平衡体系中氢气体积分数为$\frac{2mol-1.5mol}{1.5mol}$×100%=33.3%,
故答案为:33.3%.
点评 本题考查化学平衡计算与影响因素、化学平衡图象,侧重考查学生分析计算能力,(4)(5)中注意利用差量法简化计算.

| A. | 0.5a mol/L | B. | a mol/L | C. | 2.5a mol/L | D. | 5a mol/L |
| A. | Mg2+、NO3-、SO42-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
| A. | CuSO4溶液 | B. | 盐酸 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
| A. | NaH中H的化合价为-1价 | B. | H2O既不是氧化剂也不是还原剂 | ||
| C. | 该反应的离子方程式为:H-+H+═H2↑ | D. | NaOH是氧化产物 |
| A. | 化学反应不一定伴随着能量的变化 | |
| B. | 氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=571.6kJ•mol-1 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
 一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示: