题目内容
10.298K时,向某密闭容器中充入N2 、O2,发生反应N2 +O2 (g)?2NO(g),达到平衡.K=1×10-10,测得反应进行的某一时刻,N2 、O2 、N0浓度分为10mol/L、10mol/L、1×10-3mol/L,此时该反应的浓度商Q=1×10-8是否达到平衡状态?否,若要达到平衡,反应应向逆反应方向进行.分析 根据平衡常数表达式K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$计算浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行.
解答 解:由平衡常数表达式K=$\frac{{c}^{2}(NO)}{c({N}_{2})×c({O}_{2})}$可知,浓度商Qc=$\frac{(1×1{0}^{-3})^{2}}{10×10}$=1×10-8>K=1×10-10,未到达平衡状态,若要达到平衡,反应向逆反应进行,
故答案为:1×10-8;否;逆反应.
点评 本题考查化学平衡计算,涉及平衡常数应用,难度不大,化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

练习册系列答案
相关题目
1. 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O |
5.今有两种正盐的稀溶液,分别是a mol•L-1NaX溶液和b mol•L-1NaY溶液,下列说法正确的是( )
| A. | 若a=b,pH(NaX)>pH(NaY),则酸性:HX>HY | |
| B. | 若a=b,并测得c(X-)=c(HY)+c(Y-),则HX是强酸 | |
| C. | 若a>b,c(X-)=c(Y-),可推出酸性:HX>HY | |
| D. | 若两溶液等体积混合,测得c(X-)+c(HX)+c(HY)+c(Y-)=0.1mol•L-1,则可求得a=b=0.1 |
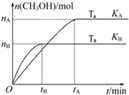 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答: 373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. _.
_. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B. CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3
COOCH2CH2CH3