题目内容
17.只由两种元素组成的化合物,其中一种元素是氢元素,这类化合物称氢化物,如NaH.NaH是一种重要的生氢剂.它与水反应的方程式为:NaH+H2O═NaOH+H2↑.下面说法正确的是( )| A. | NaH中H的化合价为-1价 | B. | H2O既不是氧化剂也不是还原剂 | ||
| C. | 该反应的离子方程式为:H-+H+═H2↑ | D. | NaOH是氧化产物 |
分析 NaH中H元素的化合价为-1价,具有强还原性,与水反应时为还原剂,水是氧化剂,每生成1mol氢气转移1mol电子.
解答 解:A.NaH中Na为+1加,则H的化合价为-1价,故A正确;
B.与水反应时NaH为还原剂,水为氧化剂,故B错误;
C.反应中NaH和水不能改写为离子,则该反应的离子方程式为:NaH+H2O═Na++OH-+H2↑,故C错误;
D.NaOH既不是氧化产物也不是还原产物,故D错误;
故选A.
点评 本题考查氧化还原反应,题目难度不大,注意正确判断元素的化合价,根据化合价的变化分析氧化还原反应.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
1.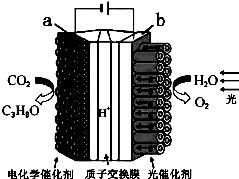 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O |
12.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
2.高氯酸铜[Cu(ClO4)2•6H2O]易溶于水,120℃开始分解,常用于生产电极和作催化剂等.可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O═Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O═2Cu(ClO4)2•6H2O+CO2↑.HClO4是易挥发的发烟液体,温度高于130℃易爆炸.下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1mol•L-1):
(1)将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液.静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀.
①把反应物研细的目的是增大反应物之间的接触面积,使反应速率增大.
②检验沉淀是否洗涤干净,应选用试剂是HNO3和AgNO3溶液.
(2)向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾.
①大量的白雾的成分是HClO4(填化学式).
②适度加热但温度不能过高的原因是防止HClO4、Cu(ClO4)2分解.
(3)25℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为2.64×10-6mol•L-1.(已知25℃时,Fe(OH)3的Ksp=2.64×10-39)
(4)某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体.请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):①将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;②加入适量双氧水溶液并充分混合,再加入适量氨水调节溶液pH至3.2~4.7,过滤;③将滤液将滤液加热浓缩,冷却结晶,过滤、(冰水)洗涤,干燥,得到CuCl2•2H2O晶体;④将将 CuCl2•2H2O晶体在HCl气氛中加热至质量不再变化为止,得到无水氯化铜固体.
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
①把反应物研细的目的是增大反应物之间的接触面积,使反应速率增大.
②检验沉淀是否洗涤干净,应选用试剂是HNO3和AgNO3溶液.
(2)向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾.
①大量的白雾的成分是HClO4(填化学式).
②适度加热但温度不能过高的原因是防止HClO4、Cu(ClO4)2分解.
(3)25℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为2.64×10-6mol•L-1.(已知25℃时,Fe(OH)3的Ksp=2.64×10-39)
(4)某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体.请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):①将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;②加入适量双氧水溶液并充分混合,再加入适量氨水调节溶液pH至3.2~4.7,过滤;③将滤液将滤液加热浓缩,冷却结晶,过滤、(冰水)洗涤,干燥,得到CuCl2•2H2O晶体;④将将 CuCl2•2H2O晶体在HCl气氛中加热至质量不再变化为止,得到无水氯化铜固体.
9.离子方程式mFe2++4H++O2=mFe3++2H2O,则m为( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答: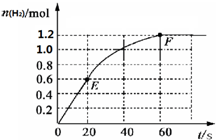 373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某 2L密闭容器中加入2mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
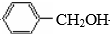 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O.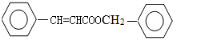 _.
_. CH2OCH2CH2CHO B.
CH2OCH2CH2CHO B.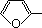 CH=CHCH2CH2CHO
CH=CHCH2CH2CHO COOCH2CH2CH3
COOCH2CH2CH3