题目内容
12.氯化镁溶液的密度为1.20g/cm3,其中镁离子的质量分数为a%,该溶液中c(Cl-)为( )| A. | 0.5a mol/L | B. | a mol/L | C. | 2.5a mol/L | D. | 5a mol/L |
分析 根据物质的量浓度c=$\frac{1000ρω}{M}$计算出镁离子的浓度,然后根据氯化镁的化学式组成计算出溶液中含有氯离子的物质的量浓度.
解答 解:氯化镁溶液的密度为1.20g/cm3,其中镁离子的质量分数为a%,则该溶液中镁离子的浓度为:$\frac{1000×1.20×a%}{24}$mol/L=0.5amol/L,
则该溶液中氯离子的浓度为:c(Cl-)=2c(《Mg2+)=0.5amol/L×2=amol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的表达式及计算方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 摩尔是表示原子、分子、离子的物理量 | |
| B. | 摩尔质量就是相对分子质量 | |
| C. | 1mol任何粒子的粒子数叫做阿伏伽德罗常数,符号为NA | |
| D. | 物质的量就是物质的质量或数量 |
3. 如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
 如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )
如图所示,把盛有几小块镁片的试管放入盛有25℃的饱和石灰水的烧杯中,再用滴管向试管中滴入2mL的稀盐酸.下列对烧杯中的实验现象的描述及原因说明中正确的是( )| A. | 烧杯中出现白色浑浊,原因是试管中的反应放出热量使烧杯中饱 和石灰水温度升高,溶质析出 | |
| B. | 烧杯中出现白色浑浊,原因是试管中的反应吸收热量使烧杯中饱和石灰水温度降低,溶质析出 | |
| C. | 烧杯中没有任何现象,原因是试管中的反应与烧杯中饱和石灰水没有关系 | |
| D. | 烧杯中没有任何现象,原因是试管中的反应既不放出热量,也不吸收热量 |
7.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、CO32-、Cl- | |
| C. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ | |
| D. | pH>7的溶液:K+、Ba2+、Cl-、NO3- |
17.下列描述正确的是( )
| A. | 胶体粒子大小介于1纳米致100纳米之间,所以纳米材料全部属于胶体 | |
| B. | CO2的水溶液能导电,所以CO2为电解质 | |
| C. | 可使用丁达尔效应来区分FeCl3溶液和Fe(OH)3胶体 | |
| D. | 1 mol 任何物质均含有约6.02×1023个原子 |
1.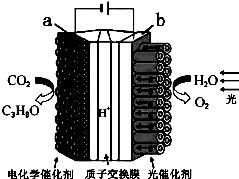 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O |
 一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答:
一定条件下,在容积为3L的密闭容器中加入1molCO和2molH2发生反应:CO(g)+2H2(g)?CH3OH(g)△H,达平衡状态.根据图示回答: