题目内容
13.某元素的最高价氧化物分子式R2O5,已知R的气态氢化物中含氢8.82%,则R的相对原子量约为31,R元素周期表中的位置为第三周期第ⅤA族.分析 化合物中正负化合价的代数和为0,由“某元素的最高价氧化物分子式R2O5”可知,元素R的化合价为+5价;则它跟氢生成的氢化物的化学式为RH3,根据氢化物中含氢为8.82%,可以计算出R的相对原子质量;元素的原子序数=质子数=核外电子数,根据原子的核外电子排布以及主族元素周期数=电子层数、主族族序数=最外层电子数.
解答 解:由“某元素的最高价氧化物分子式R2O5”可知,元素R的化合价为+5价;则它的氢化物的化学式为RH3,设R的相对原子质量为x,则$\frac{3}{x+3}$×100%=8.82%,解得:x=31,该元素为磷元素,原子序数为15,原子结构示意图为 ,由3个电子层,处于第三周期,最外层电子数为5,处于ⅤA族,故该元素处于第三周期第ⅤA族;
,由3个电子层,处于第三周期,最外层电子数为5,处于ⅤA族,故该元素处于第三周期第ⅤA族;
故答案为:31;第三周期第ⅤA族.
点评 本题考查了相对原子质量的求算和元素位置的确定,应注意的是电子层数等于周期序数,难度不大.

练习册系列答案
相关题目
4.通式为CnH2n+1OH(n≠1)的醇不能发生消去反应,n的最小值是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
1.关于原子结构的叙述不正确的是( )
| A. | 所有的原子核都是由质子和中子组成的 | |
| B. | 原子的最外层电子数不超过8个 | |
| C. | 稀有气体原子的最外层电子数为2或8 | |
| D. | 原子的次外层电子数可能为8 |
18.下列气态氢化物最不稳定的是( )
| A. | CH4 | B. | SiH4 | C. | PH3 | D. | H2S |
5.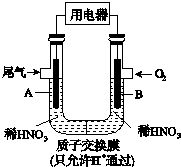 某研究小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某研究小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
 某研究小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )
某研究小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料.下列说法正确的是( )| A. | 电解质溶液中电流的方向由B到A,电子的流向与之相反 | |
| B. | 电极A表面反应之一为NO-3e-+2H2O═NO${\;}_{3}^{-}$+4H+ | |
| C. | 电极B附近的c(NO${\;}_{3}^{-}$)增大 | |
| D. | 该电池工作时,每转移4 mol电子,消耗标准状况O222.4 L |
16.有两种饱和一元醇组成的混合物 0.91克足量的金属钠作用生成224mLH2(标况),该混合物可能是( )
| A. | CH3CH2OH 和 CH3CH2CH2OH | B. | CH3CH2OH 和 CH3CHOH CH2CH3 | ||
| C. | CH3CH2OH 和 CH3OH | D. | CH3CH2CH2OH 和 CH3 (CH)3CHOH |
 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液;X、Y都是惰性电极,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液;X、Y都是惰性电极,通过导线与直流电源相连.请回答以下问题: