题目内容
6.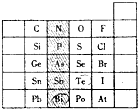 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分. (l)阴影部分元素 N 在元素周期表中的位置为第二周期第ⅤA族.根据元素周期期律,请你预测H3AsO4、H3PO4的酸性强弱H3PO4>H2AsO4
(2)判断表中Bi和Te两种元素的金属性强弱:Bi>Te(填“>”、“<”或“=”).
(3)Br2具有较强的氧化性,SO2具有较强的还原性,请写出SO2气体通入溴水后反应的离子方程式:SO2+Br2+2H2O=4H++SO42-+2Br-.
分析 (1)根据元素周期表中的排布规律:最外层电子数=族序数,电子层数等于周期数以及元素最高价氧化物对应水化物的酸性强弱来回答;
(2)同一周期中原子序数越大,金属性越弱,同一主族中,原子序数越大,非金属性越强,据此进行判断;
(3)将SO2气体通入溴水后,会发生氧化还原反应生成硫酸和溴化氢,据此写出反应的离子方程式.
解答 解:(1)阴影部分元素的最外层电子数均为5,最外层电子数=族序数,所以均是第ⅤA族的元素,氮元素的电子层数等于周期数=2,所以是第二周期的元素,同周期元素,从左到右最高价氧化物对应水化物的酸性逐渐增强,同主族从上到下最高价氧化物对应水化物的酸性逐渐减弱,所以酸性:H3PO4>H2AsO4,
故答案为:第二周期第ⅤA族;H3PO4>H2AsO4;
(2)Bi与Po处于同一周期,原子序数:Bi<Po,则金属性:Bi>Po;Te与Po处于同一主族,原子序数:Te<Po,则金属性:Te<Po,所以Bi和Te的金属性大小为:Bi>Te,
故答案为:>;
(3)Br2具有较强的氧化性,SO2具有较强的还原性,二氧化硫与溴水反应生成硫酸和溴化氢,反应的离子方程式为:SO2+Br2+2H2O=4H++SO42-+2Br-,
故答案为:SO2+Br2+2H2O=4H++SO42-+2Br-.
点评 本题考查元素周期表与元素周期律的应用,题目难度中等,注意熟练掌握元素周期表结构、元素周期律内容,试题注重培养学生对规律性知识进行归纳总结的能力.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
19.下列离子方程式书写正确的是( )
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
17.在如图所示的原电池中,下列说法不正确的是( )
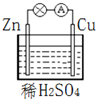

| A. | 该装置能将电能转化为化学能 | B. | 电子由锌片通过导线流向铜片 | ||
| C. | 负极反应为 Zn-2e-═Zn2+ | D. | Cu为正极材料,正极发生还原反应 |
1.一般来说,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质.下列关于同主族元素所形成的物质的性质推理中,正确的是( )
| A. | Na 与 Cl2反应能形成离子键,故 K与 Cl2反应也能形成离子键 | |
| B. | Cl2 能置换出 NaBr溶液中的溴,故I2也能置换出NaBr溶液中的溴 | |
| C. | Li在氧气中燃烧生成 Li2O,故Na在氧气中燃烧也生成Na20 | |
| D. | C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在 |
18.下列几种化学电池中,不属于可充电电池的是( )
| A. | 碱性锌锰电池 | B. | 手机用锂电池 | C. | 汽车用铅蓄电池 | D. | 玩具用镍氢电池 |
15.下列叙述中正确的是( )
| A. | P4和NO2都是共价化合物 | |
| B. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 甲烷是对称的平面结构,所以是非极性分子 |
16.用下列装置不能达到有关实验目的是( )
| A. |  用图装置电解精炼铝 用图装置电解精炼铝 | |
| B. |  用图装置制备Fe(OH)2 用图装置制备Fe(OH)2 | |
| C. |  用图装置可制得金属锰 用图装置可制得金属锰 | |
| D. |  用图装置验证NaHCO3和Na2CO3的热稳定性 用图装置验证NaHCO3和Na2CO3的热稳定性 |

 ,写出水分子的电子式
,写出水分子的电子式 .
.