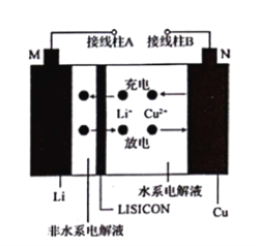
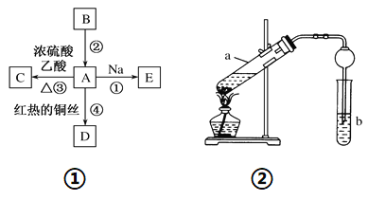
题目内容
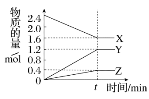
【题目】在某温度时将a mol/L 氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是

A. a<1.0 B. 水的电离程度:b<d<c
C. C点:c(NH4+)=1.0mol/L D. d点:c(Cl-)<c(NH4+)
【答案】D
【解析】酸碱中和反应是放热反应,反应过程中会导致溶液温度升高,弱电解质的电离是吸热过程,一水合氨是弱电解质,所以一水合氨电离过程中吸收热量,当温度最高时氨水和盐酸恰好完全反应,二者的物质的量相等,根据图知,二者完全反应时氨水体积小于![]() ,则氨水浓度大于
,则氨水浓度大于![]() ,即a>1.0 ,A错误;酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中
,即a>1.0 ,A错误;酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中![]() 或碱中
或碱中![]() 越大,其抑制水电离程度越大;b点溶液温度最高,说明二者恰好完全反应生成氯化铵,所以溶质为
越大,其抑制水电离程度越大;b点溶液温度最高,说明二者恰好完全反应生成氯化铵,所以溶质为![]() ,
,![]() 溶液呈酸性,要使混合溶液呈中性,则氨水应该过量,所以c点溶液中溶质为
溶液呈酸性,要使混合溶液呈中性,则氨水应该过量,所以c点溶液中溶质为![]() 和
和![]() ,d点溶液中溶质为
,d点溶液中溶质为![]() 和
和![]() ,且
,且![]() ,d点抑制水电离, b、c点促进水电离,但b点促进水电离程度大于c,所以水电离程度大小顺序是b> c> d;B错误;c点溶液呈中性,则c(Cl-)=c(NH4+),因为溶液体积是盐酸的二倍,所以
,d点抑制水电离, b、c点促进水电离,但b点促进水电离程度大于c,所以水电离程度大小顺序是b> c> d;B错误;c点溶液呈中性,则c(Cl-)=c(NH4+),因为溶液体积是盐酸的二倍,所以![]() 是原来的一半,为0.5mol/L,c(NH4+)=0.5mol/L, C错误;d点时,溶质为
是原来的一半,为0.5mol/L,c(NH4+)=0.5mol/L, C错误;d点时,溶质为![]() 和
和![]() ,且
,且![]() ,d点抑制水电离,电离大于水解,所以c(Cl-)<c(NH4+),D正确;正确选项D。
,d点抑制水电离,电离大于水解,所以c(Cl-)<c(NH4+),D正确;正确选项D。

练习册系列答案
相关题目