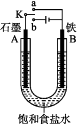
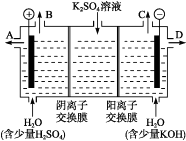
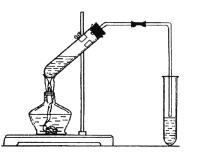
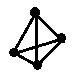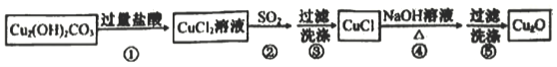题目内容
【题目】萜类化合物具有重要的生理活性,是研究天然产物和开发新药的重要来源。 (c)、
(c)、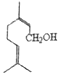 (n)、
(n)、 (t)均为常见萜类化合物,下列说法不正确的是
(t)均为常见萜类化合物,下列说法不正确的是
A. c、n互为同分异构体 B. n中所有碳原子可能处于同一平面
C. c、n、t均可以发生聚合反应 D. c、n、t均可使酸性KMnO4溶液褪色
【答案】C
【解析】A、c的分子式为C10H18O,n的分子式为C10H18O,前者属于醛,后者属于醇,因此两者互为同分异构体,故A说法正确;B、n中碳碳双键中C原子杂化类型为sp2,立体构型为平面形,以及三点确定一个平面,因此n中所有碳原子可能处于同一平面,故B说法正确;C、t中不含有碳碳双键,不能发生聚合反应,故C说法错误;D、c、n中含有碳碳双键,能使酸性高锰酸钾溶液褪色,t中含有羟基,羟基能被酸性高锰酸钾溶液氧化,故D说法正确。

练习册系列答案
相关题目