题目内容
【题目】在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时刻达到平衡,依图所示:
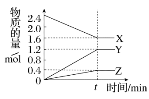
(1)该反应的化学方程式是________________________________________________。
(2)反应起始至t,Y的平均反应速率是____________。
(3)X的转化率是________。
(4)关于该反应的说法正确的是________。
A.到达t时刻该反应已停止
B.在t时刻之前X的消耗速率大于它的生成速率
C.在t时刻正反应速率等于逆反应速率
D.在t时刻达到平衡是因为此时反应物总物质的量与生成物总物质的量相等
(5)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有________ mol A,此时C的物质的量浓度为________________。
【答案】 2X![]() 3Y+Z
3Y+Z ![]() mol/(L·min) 33.3% BC 8.8 0.08 mol·L-1
mol/(L·min) 33.3% BC 8.8 0.08 mol·L-1
【解析】(1)化学反应中,各物质的物质的量的变化值与化学计量数呈正比,以此书写化学方程式;(2)根据v=△c/△t计算反应速率;(3)根据X变化的物质的量与起始物质的量之比计算.(4)A、可逆反应是动态平衡;B、可逆反应,V正=V逆时,处于平衡状态;V正>V逆时,向正反应方向进行;V正<V逆时,向逆反应方向进行,据此判断;C、化学反应达到平衡状态时,正逆反应速率相等;D、反应到达平衡的本质是V正=V逆,其外在表现为反应中各物质的物质的量不变化,各物质的浓度不变,由此衍生的一些物理量不变。(5)由反应速率和时间求出消耗的A的物质的量,根据变化的物质的量之比等于化学计量数之比求出生成的C的物质的量,即得到容器中C的物质的量,浓度c=n/V。
(1)由图象可以看出,X的物质的量逐渐减小,则X为反应物,Y、Z的物质的量逐渐增多,作为Y、Z为生成物,当反应到达2min时,△n(X)=0.8mol,△n(Y)=1.2mol,△n(Z)=0.4mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(X):△n(Y):△n(Z)=2:3:1,所以反应的化学方程式为:2X![]() 3Y+Z;(2)v(Y)=△c/△t=1.2mol/(2L·tmin)=0.6/t mol/(L·min);(3)X的起始物质的量为2.4mol,达到平衡时减小了0.8mol,所以X的物质的转化率为:0.8mol/2.4mol×100%=33.3%;(4)A、可逆反应是动态平衡,t时刻,达到平衡状态,正逆反应速率相等,但不为零,故A错误;B、在t时刻之前,可逆反应未达到平衡,反应向正反应方向进行,V正>V逆,即X的消耗速率大于它的生成速率,故B正确;C、t时刻,反应达到平衡状态,正逆反应速率相等,即Y的正反应速率等于逆反应速率,故C正确;D、反应到达平衡的本质是V正=V逆,故D错误;故选BC;(5)在最初2s内,消耗A的平均速率为0.06mol·L-1·s-1,则消耗A的物质的量为0.06mol·L-1·s-1×2s×10L=1.2mol,则
3Y+Z;(2)v(Y)=△c/△t=1.2mol/(2L·tmin)=0.6/t mol/(L·min);(3)X的起始物质的量为2.4mol,达到平衡时减小了0.8mol,所以X的物质的转化率为:0.8mol/2.4mol×100%=33.3%;(4)A、可逆反应是动态平衡,t时刻,达到平衡状态,正逆反应速率相等,但不为零,故A错误;B、在t时刻之前,可逆反应未达到平衡,反应向正反应方向进行,V正>V逆,即X的消耗速率大于它的生成速率,故B正确;C、t时刻,反应达到平衡状态,正逆反应速率相等,即Y的正反应速率等于逆反应速率,故C正确;D、反应到达平衡的本质是V正=V逆,故D错误;故选BC;(5)在最初2s内,消耗A的平均速率为0.06mol·L-1·s-1,则消耗A的物质的量为0.06mol·L-1·s-1×2s×10L=1.2mol,则
3A(g)+B(g)![]() 2C(g)
2C(g)
起始 10mol 5mol 0
转化 1.2mol 0.4mol 0.8mol
2s 8.8mol 4.6mol 0.8mol
则在2s时,容器中有8.8 mol A,此时C的物质的量浓度为0.8mol/10L=0.08mol·L-1。

 阅读快车系列答案
阅读快车系列答案