题目内容
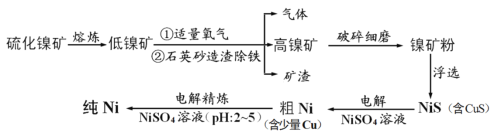
【题目】元素Ni用途广泛,工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备并精制镍的基本流程如下:
已知:①电极电位(E)能体现微粒的氧化还原能力强弱,如:
H2 -2e-= 2H+ E=0.00V; Cu-2e- =Cu2+ E=0.34V;
Fe -2e-= Fe2+ E=-0.44V; Ni-2e-=Ni2+ E=-0.25V
②常温下溶度积常数 Ksp(NiS)=1.07×10-21; Ksp(CuS)=1.27×10-36
(1)可用光洁的镍丝代替铂丝蘸取化学试剂在焰色反应实验中灼烧,原因是_________。
(2)就制备高镍矿的相关问题请回答:
①通入氧气时控制适量的目的是________________。
②已知矿渣能使酸性高锰酸钾溶液褪色,原因是__________________。
(3)电解制粗镍时阳极发生的主要电极反应式___________________。
(4)电解精炼镍的过程需控制pH为2~5,试分析原因__________________。
(5)工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+) 为0.107 mol/L,则滤液中残留的c(Cu2+)为________ mol/L。
【答案】镍的焰色反应为无色 将部分硫元素转化为SO2除去;防止氧化Fe2+,便于用石英砂造渣除铁 矿渣中含有Fe2+ NiS-2e-=Ni2++S 根据电极电位可知,H+先于Ni2+放电,当pH<2时,c(H+)大,易在阳极放电,当pH>5时,c(OH-)增大,Ni2+易生成Ni(OH)2沉淀 1.27×10-16
【解析】
根据流程:将硫化镍矿(含少量杂质硫化铜、硫化亚铁)熔炼后将部分硫元素以二氧化硫的形式除去,二氧化硫可用于制硫酸,得到低镍矿,加入适量的氧气,用石英造渣除铁得到Fe2SiO4,反应为:SiO2+2FeO![]() 2FeOSiO2,将得到高镍矿浮选出NiS(含CuS),为提高浮选率,将其破碎细磨,将NiS(含CuS)在NiSO4溶液中电解,阳极的反应为:NiS-2e-=Ni2++S、CuS-2e-=Cu2++S,阴极为:Ni2++2e-=Ni,Cu2++2e-=Cu,制得粗Ni含有少量Cu,将粗Ni用NiSO4溶液,控制pH为2~5,电解精炼,粗Ni为阳极,反应为:Ni-2e-=Ni2+,Cu从粗Ni脱落形成阳极泥,阴极为Ni2++2e-=Ni,阴极制得精Ni,据此分析作答。
2FeOSiO2,将得到高镍矿浮选出NiS(含CuS),为提高浮选率,将其破碎细磨,将NiS(含CuS)在NiSO4溶液中电解,阳极的反应为:NiS-2e-=Ni2++S、CuS-2e-=Cu2++S,阴极为:Ni2++2e-=Ni,Cu2++2e-=Cu,制得粗Ni含有少量Cu,将粗Ni用NiSO4溶液,控制pH为2~5,电解精炼,粗Ni为阳极,反应为:Ni-2e-=Ni2+,Cu从粗Ni脱落形成阳极泥,阴极为Ni2++2e-=Ni,阴极制得精Ni,据此分析作答。
(1)镍丝灼烧时火焰呈无色,不影响其他金属元素的焰色,故焰色反应实验可以用光洁的镍丝代替铂丝蘸取化学试剂灼烧;
(2)①通入氧气时控制适量的目的是可以使其中的S元素氧化为SO2气体逸出,同时又防止氧化Fe2+,便于用石英砂造渣除铁;
②已知矿渣能使酸性高锰酸钾溶液褪色,原因是矿渣中含有Fe2+,Fe2+具有还原性,与具有氧化性的酸性高锰酸钾发生氧化还原反应而使酸性高锰酸钾溶液的紫色褪去;
(3)电解制粗镍时阳极上是NiS失去电子,发生氧化反应,主要电极反应式为:NiS-2e-=Ni2++S;
(4)根据电极电位可知,H+先于Ni2+放电,当pH<2时,c(H+)大,易在阳极放电,当pH>5时,c(OH-)增大,Ni2+易生成Ni(OH)2沉淀,所以电解精炼镍的过程需控制pH为2~5;
(5)工业生产中常用加NiS的方法除去溶液中的Cu2+,若过滤后溶液中c(Ni2+)为0.107 mol/L,由于Ksp(NiS)=1.07×10-21,则溶液中S2-浓度为c(S2-)=![]() mol/L=1.0×10-20mol/L,根据Ksp(CuS)=1.27×10-36,可知滤液中残留的c(Cu2+)=
mol/L=1.0×10-20mol/L,根据Ksp(CuS)=1.27×10-36,可知滤液中残留的c(Cu2+)=![]() mol/L=1.27 ×10-16mol/L。
mol/L=1.27 ×10-16mol/L。

【题目】电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(1)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________。
(2)25 ℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
(3)NaCN溶液中通入少量CO2,所发生反应的化学方程式为___________。
(4)25 ℃时, pH=8的CH3COONa溶液中,c(Na+)-c(CH3COO-)=___________。
【题目】下列有关水溶液中的平衡相关的问题,请填空
(1)已知常温下,将氯化铝溶液和碳酸钠溶液混合,有白色沉淀产生,写出反应离子方程式______________
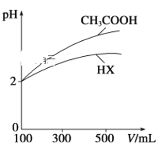
(2)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示。同浓度,同体积的CH3COONa与NaX溶液,离子总数目: CH3COONa溶液_______NaX溶液(填>,<,=)
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
①25℃时,浓度均为0.01 mol·L-1 HCN和NaCN混合溶液显_____性(填酸,碱,中)。溶液中HCN浓度_________CN-浓度(填>,<,=)
②25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中![]() =____。
=____。
(4)在25°C下,将x mol·L-1的氨水与y mol·L-1的盐酸等体积混合,反应后溶液中显中性,则c(NH4+)____c(Cl-)(填“>” 、“<” 或“=” );用含x和y的代数式表示出氨水的电离平衡常数______。