题目内容
13.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )
| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:Y>Z>X | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,结合元素周期律与物质的性质等解答.
解答 解:同周期自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素,
A.X为O元素,O元素没有+6价,R为S元素,最高价为+6价,故A错误;
B.X为O元素,Y为Na元素,Z为Al元素,分别形成的O2-、Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小,简单离子的半径:O2->Na+>Al3+,故B错误;
C.Y、Z、R对应的最高价氧化物的水化物分别为:NaOH、Al(OH)3、H2SO4,氢氧化钠与硫酸发生中和反应,氢氧化铝属于两性氢氧化物,能与氢氧化钠、硫酸反应,故C正确;
D.工业上电解熔融的Al2O3冶炼Al,故D正确;
故选AB.
点评 本题考查位置结构性质的关系及应用,为高频考点,侧重于学生的分析能力的考查,题目难度中等,推断元素是解题的关键,根据原子半径变化规律结合原子序数进行推断,首先审题中要抓住“短周期主族元素”几个字.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
3.下列有机分子中,所有的原子不可能处于同一平面的是( )
| A. | CH2=CHCN | B. | CH2=CH-CH=CH2 | C. |  | D. |  |
4. 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )| A. | a点时升高温度,溶液pH增大 | |
| B. | b点c(CH3COO-)<c(CH3COOH) | |
| C. | c点对应的NaOH溶液的体积V=20mL | |
| D. | d点c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
1.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA | |
| B. | 0.1mol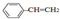 中含有双键的数目为0.4NA 中含有双键的数目为0.4NA | |
| C. | 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
8.在日常生活中,下列解决问题的方法不可行的是( )
| A. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中 | |
| C. | 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C | |
| D. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 |
18.常温,下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在透明溶液中:Na+、Cu2+、SO42-、NO3- | |
| C. | 在c(H+)=10-13 mol/L的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
2.某有机物的结构简式如图所示.下列关于该有机物的叙述错误的是( )


| A. | 分子式为C12H14O3 | B. | 分子中含有三种含氧官能团 | ||
| C. | 能够发生加成反应和取代反应 | D. | 可使溴水和酸性高锰酸钾溶液褪色 |
3.设NA 代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 30g HCHO与过量的新制的氢氧化铜悬浊液反应转移了4NA个电子 | |
| B. | 1L 1mol/L 醋酸溶液中分子总数小于NA | |
| C. | 在1mol-CHO中所含电子数为15NA | |
| D. | 1mol CaHxNbOc的有机物中,H最多(2a+b+2)NA |
 氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.
氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.