题目内容
14.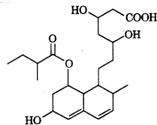 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的描述错误的是( )| A. | 分子中含有四种官能团 | |
| B. | 1 mol该物质最多可与3 mol NaOH反应 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 1 mol该物质最多可与2 mol H2发生加成反应 |
分析 该有机物中含有酯基、醇羟基、碳碳双键和羧基,具有酯、醇、烯烃、羧酸的性质,能发生水解反应、氧化反应、消去反应、加成反应、加聚反应、中和反应等,据此分析解答.
解答 解:A.该有机物中含有酯基、醇羟基、碳碳双键和羧基,四种官能团,故A正确;
B.能和NaOH反应的是羧基和酯基水解生成的羧基,所以1 mol该物质最多可与2mol NaOH反应,故B错误;
C.该有机物中含有酯基、醇羟基、碳碳双键和羧基,具有酯、醇、烯烃、羧酸的性质,能发生水解反应、氧化反应、消去反应、加成反应、加聚反应、中和反应等,故C正确;
D.碳碳双键能和氢气发生加成反应,所以1 mol该物质最多可与2 mol H2发生加成反应,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查醇、酯、羧酸和烯烃性质,注意该物质中不含酚羟基而是醇羟基,易错选项是B.

练习册系列答案
相关题目
4. 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )| A. | a点时升高温度,溶液pH增大 | |
| B. | b点c(CH3COO-)<c(CH3COOH) | |
| C. | c点对应的NaOH溶液的体积V=20mL | |
| D. | d点c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
2.某有机物的结构简式如图所示.下列关于该有机物的叙述错误的是( )


| A. | 分子式为C12H14O3 | B. | 分子中含有三种含氧官能团 | ||
| C. | 能够发生加成反应和取代反应 | D. | 可使溴水和酸性高锰酸钾溶液褪色 |
9.下列含有羟基的化合物的水溶液显中性的是( )
| A. | HONO2 | B. | HOCH3 | C. | KOH | D. | CH3COOH |
19.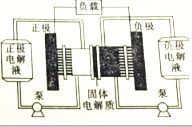 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
 燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )
燃料电池实质上不能“储电”而是一个发电厂.某锂-铜空气燃料电池通过一种复杂的“铜腐蚀现象”产生电路,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是( )| A. | 该电池应该在负极通入空气 | |
| B. | 放电时,Li+透过固体电解质向负极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+2e-═2Cu+O2- | |
| D. | 整个反应过程中,铜相当于催化剂,氧化剂实质是O2 |
3.设NA 代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 30g HCHO与过量的新制的氢氧化铜悬浊液反应转移了4NA个电子 | |
| B. | 1L 1mol/L 醋酸溶液中分子总数小于NA | |
| C. | 在1mol-CHO中所含电子数为15NA | |
| D. | 1mol CaHxNbOc的有机物中,H最多(2a+b+2)NA |
4.下列有关“化学与生活”的叙述不正确的是( )
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
 氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.
氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.