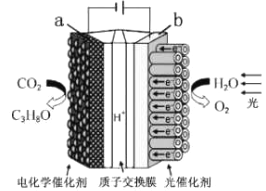
题目内容
【题目】氢能被誉为21世纪的“终极能源”,具有高效、高压、环保、体积小等特点,氢能转化被视为新能源汽车终极解决方案,也是资本与技术趋之若鹜的领域。镧镍合金LaNix是一种良好的储氢材料。工业上可用下列方法冶炼镍。
![]()
(1)一个电子的运动状态取决于________种因素,基态Ni原子核外电子占据_____个不同原子轨道。
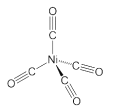
(2)CO分子内σ键和π键个数之比为________;已知Ni(CO)4的结构如图所示,中心原子Ni的杂化类型为_________,Ni原子参与形成了______个配位键,Ni(CO)4属于______晶体,理由是________________________________。
(3)研究发现镧镍合金LaNix属六方晶系,其晶胞如图a中实线或图a所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

①LaNix合金中x的值为_______;
②晶胞中和“![]() ”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______________g/cm-3(保留2位有效数字,NA=6.0×1023![]() =1.7)。
=1.7)。
【答案】4 15 1:2 sp3 4 分子 Ni(CO)4不存在离子键,晶体的构成微粒是分子,微粒间的相互作用力是分子间作用力 5 3 6 0.18
【解析】
利用均摊法求出晶胞中的La与Ni的原子个数比,进而得出化学式;结合几何关系,找出六方晶胞的体积,再依据密度公式作答。
(1)一个电子的运动状态取决于它所处的电子层、电子亚层、轨道的空间伸展方向和自旋状态4种因素,基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,基态Ni原子核外电子占据15个不同原子轨道。
(2)CO分子内存在三键,σ键和π键个数之比为1:2; 由图可知,Ni(CO)4中心原子Ni的杂化类型为sp3,Ni原子参与形成了4个配位键,Ni(CO)4属于分子晶体,理由是Ni(CO)4不存在离子键,晶体的构成微粒是分子,微粒间的相互作用力是分子间作用力。
(3)①该晶体的晶胞不是六棱柱,而是实线部分表示的平行六面体,各原子在晶胞中的位置可参考a,b,如果将平行六面体抽取出来,晶胞如a’所示,La在顶点,Ni在面心有4个,其中顶层和底层各2个,均摊后各1个,前后左右4个面各1个,均摊后共2个;体心1个,故LaNix合金中x的值为5;
②根据b,c结构可知,晶胞中和“![]() ”同类的八面体空隙有3个,和“▲”同类的四面体空隙有6个。
”同类的八面体空隙有3个,和“▲”同类的四面体空隙有6个。
③六方晶胞的体积为V=a2csinθ=(500×10-10)2×400×10-10×sin60°=8.5×10-23,密度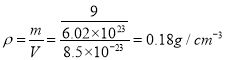 。
。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.若温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应